Класс – 8 (базовый уровень)
Учебные задачи:
- Сформировать понятие окислительно-восстановительных реакций.
- Сформулировать принцип классификация химических реакций по признаку изменения степени окисления элементов.
- Дать понятие «окислитель» и «восстановитель».
- Показать единство и неразрывность процессов окисления и восстановления.
- Систематизировать знания о химических реакциях, о степенях окисления химических элементов.
- Научить записывать уравнения ОВР, расставлять коэффициенты в уравнениях химических реакций методом электронного баланса.
Планируемые результаты на базовом уровне у восьмиклассников:
Предметный результат: ученик научиться характеризовать ОВР; определять окислитель и восстановитель; составлять ОВР, используя метод электронного баланса.
Метапредметный результат: ученик овладеет умениями работать с текстовой информацией (учебник); осуществлять логические операции при определении коэффициентов в ОВР методом электронного баланса; осуществлять самоконтроль и оценку своей деятельности.
Личностный результат: ученик убедится на практике в значимости правильно излагать свои мысли, формулировать вопросы; понимать о значении ОВР в природе и жизни человека.
Какими знаниями, умениями и навыками должен обладать ученик для успешного овладения материалом урока:
- иметь опыт работы с различными источниками информации (таблица Д.И.Менделеева, таблица растворимости, ряд активности металлов, ряд электроотрицательности);
- знать основные типы химических реакций;
- уметь записывать уравнения химических реакций; определять значения степени окисления химических элементов;
- уметь обращаться с химическим оборудованием;
- делать выводы по результатам эксперимента.
Метод обучения: фронтальный, проблемный.
Средства обучения:
- Химия 8 класс: учебник для общеобразовательных учреждений/ О.С.Габриелян, М:.Дрофа. 2017.
- Рабочая тетрадь.
- Источники информации: таблица Д.И.Менделеева, таблица растворимости, ряд активности металлов, ряд электроотрицательности.
Оборудование для проведения эксперимента: спиртовка, держатель для пробирок, спички, р-р гидроксида натрия, р-р сульфата меди (II), штатив с пробиркой, инструкция для проведения опыта.
Ход урока
Деятельность учителя |
Деятельность ученика |
||||||||||||
1. Организационный момент. (1 минута) Приветствие учеников. |
|||||||||||||
2. Актуализация знаний. (Продолжительность данного этапа составляет 8 минут) |
|||||||||||||
Вокруг нас происходит множество химических |
Записываем уравнение
химической реакции на доске и в тетрадях: |
||||||||||||
| Проведём эксперимент: у вас на столах оборудование и, согласно инструкции (приложение № 1), проведите опыт, запишите цепочку превращений и решите её, записав уравнения химических реакций. Во время проведения опыта не забывайте о технике безопасности при работе со спиртовкой, стеклом. |
CuSO4→Cu(OH)2→ CuO→Cu 1. CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4 2. Cu(OH)2 → CuO + H2O 3. 4Cu+2O–2 → 2Cu2O0 + O20 |
||||||||||||
Вспомните, что такое степень окисления, как определить степень окисления в сложных веществах? |
Задание: в каждом уравнении определите степень окисления каждого элемента в формулах. |
||||||||||||
3. Изучение нового материала. (Продолжительность данного этапа составляет 12 минут) |
|||||||||||||
Таким образом, видим, что степень окисления у
элементов изменяется в уравнении (3).
Такие реакции называются окислительно-восстановительными (реакции, в ходе которых у химических элементов изменяется степень окисления). |
Записываем определение ОВР. |
||||||||||||
Делаем вывод: в ходе ОВР происходят два
процесса: Что происходит со значением степени окисления? (уменьшается). Такая частица называется «окислитель» |
Составляем конспект в
тетради: |
||||||||||||
Окисление – это процесс отдачи электронов атомами, молекулами, ионами. Что происходит со значением степени окисления? (увеличивается). Такая частица называется «восстановитель» |
2H–1 - 2e–- → H20 |
||||||||||||
Таким образом, видим, что все ОВР находятся
во власти электронных переходов от одного атома к другому атому как внутри молекулы |
|
||||||||||||
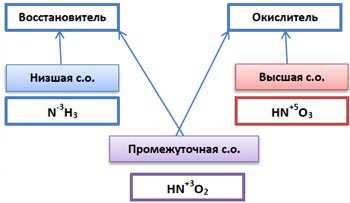
Для определения окислительно-восстановительных свойств элемента можно использовать схему:
|
Записываем в тетрадь схему. |
||||||||||||
Задание: определите, какие процессы относятся
к процессам окисления, а какие к процессам восстановления: |
Записываем в тетрадь:
|
||||||||||||
4. Проблемный вопрос. (Продолжительность данного этапа составляет 6 минут) |
|||||||||||||
Во многих ОВР очень трудно расставить коэффициенты. Для этого используют метод электронного баланса, который основан на сравнении степеней окисления в исходных и конечных веществах. |
Работа с текстом учебника §44, стр. 265. |
||||||||||||
Вопрос: Где человек использует ОВР? |
Записываем в тетрадь основные тезисы. |
||||||||||||
5. Закрепление. (Продолжительность данного этапа составляет 14 минут) |
|||||||||||||
1. Из приведенных схем укажите реакции, которые можно отнести к ОВР: 1) CaCO3 → Ca + CO2 2) 2KMnO4 → K2MnO4 + MnO2 + O2 3) 2CuS + 3O2 → 2CuO + 2SO2 |
Записываем в тетрадь
уравнения химических реакций: ОВР ОВР |
||||||||||||
2. Расставьте коэффициенты в уравнениях
|
Записываем в тетрадь уравнения химических реакций (приложение № 3). Происходит само- и
взаимопроверка, под непосредственным контролем |
||||||||||||
6. Домашнее задание. § 44; № 4,5,6,7 стр. 268-269 (1 минута) |
|||||||||||||
7. Рефлексия. (Продолжительность данного этапа составляет 3 минуты) |
|||||||||||||
Осуществляет как коммуникативное
взаимодействие, так и индивидуальную форму работы. В качестве индивидуальной работы учащимся предлагается заполнить лист
достижений и лист оценивания. |
В ходе фронтальной беседы учащиеся анализируют, где и почему были допущены ошибки, каким способом они были исправлены, проговаривают способы действий, вызвавшие затруднение, оценивают свою деятельность на уроке. Фиксируют степень соответствия поставленной
|
||||||||||||
|
Оценивают собственную деятельность на уроке (заполнить таблицу):
|
||||||||||||