Цель урока: изучение свойств аммиака на основе его строения и применения на основе свойств.
Задачи:
- Образовательные:
- изучить строение, физические и химические свойства аммиака, получение;
- значение аммиака и его физиологическое действие на организм человека;
- закрепить знания об основных правилах техники безопасности при работе с газообразными едкими веществами, показать научность объяснения фактов.
- Развивающие:
- практические умения и навыки обучающихся;
- умения работать в группе; умения осуществлять самостоятельную деятельность на уроке;
- коммуникативные и познавательные компетенции; основы критического мышления.
- Воспитательные:
- способствовать повышению уровня познавательного интереса к предмету, развитию кругозора, воспитывать творческую, целеустремленную деятельную личность, стремящуюся к самостоятельным открытиям; воспитывать чувство коллективизма;
- формировать основы научного мировоззрения;
- адекватную самооценку;
- основы здорового образа жизни.
Планируемые результаты обучения:
- Личностные:
- готовность и способность к выполнению норм и требований школьной жизни, прав и обязанностей ученика;
- умение вести диалог на основе равноправных отношений и взаимного уважения и принятия;
- устойчивый познавательный интерес и становление смыслообразующей функции познавательного мотива;
- готовность к выбору профильного образования.
Метапредметные:
- Познавательные УУД:
- выделять и формулировать познавательную цель всего урока;
- проводить наблюдение и делать выводы;
- создавать и преобразовывать модели и схемы для решения задач;
- устанавливать причинно-следственные связи; осуществлять логическую операцию установления родовидовых отношений, ограничение понятия;
- обобщать понятия — осуществлять логическую операцию перехода от видовых признаков к родовому понятию, от понятия с меньшим объемом к понятию с большим объемом;
- осуществлять сравнение, сериацию и классификацию, самостоятельно выбирая основания и критерии для указанных логических операций;
- строить логическое рассуждение, включающее установление причинно-следственных связей;
- выдвигать гипотезы о связях и закономерностях событий, процессов, объектов;
- объяснять явления, процессы, связи и отношения, выявляемые в ходе исследования.
- Коммуникативные УУД:
- организовывать и планировать учебное сотрудничество с учителем и сверстниками, определять цели и функции участников, способы взаимодействия; планировать общие способы работы;
- работать в группе — устанавливать рабочие отношения, эффективно сотрудничать и способствовать продуктивной кооперации;
- интегрироваться в группу сверстников и строить продуктивное взаимодействие со сверстниками и взрослыми;
- учитывать разные мнения и стремиться к координации различных позиций в сотрудничестве;
- формулировать собственное мнение и позицию, аргументировать и координировать её с позициями партнёров в сотрудничестве при выработке общего решения в совместной деятельности;
- отображать в речи (описание, объяснение) содержание совершаемых действий как в форме громкой социализированной речи, так и в форме внутренней речи.
- Регулятивные УУД:
- целеполагание, включая постановку новых целей, преобразование практической задачи в познавательную;
- планирование путей достижения целей;
- осуществление констатирующего и предвосхищающего контроля по результату и по способу действия;
- актуальный контроль на уровне произвольного внимания;
- адекватно самостоятельно оценивать правильность выполнения действия и вносить необходимые коррективы в исполнение как в конце действия, так и по ходу его реализации;
- основы прогнозирования как предвидения будущих событий и развития процесса.
- Предметные:
- составлять названия веществ по их формулам;
- объяснять строение веществ;
- объяснять физические и химические свойства на основе строения веществ;
- называть общие химические свойства, характерные для оснований;
- определять кислотно-основные и окислительно-восстановительные свойства веществ
- приводить примеры реакций, подтверждающих специфические химические свойства аммиака;
- приводить исторические факты развития науки;
- получать, собирать и доказывать наличие аммиака;
Ресурсы:
- учебник, периодическая таблица химических элементов Д.И.Менделеева, таблица растворимости мультимедийное оборудование, оборудование и реактивы для получения и собирания аммиака (пробирки, пробка с изогнутой газоотводной трубкой, спиртовка;
- щелочь, хлорид аммония, фенолфталеин, лакмусовая бумага, кислота).
Ход урока
I. Организационная часть урока
Сегодня на уроке мы с вами познакомимся и попытаемся разгадать, для нас пока еще тайны, удивительного вещества: в европейских языках его название звучит как «аммониак»), своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является это вещество. По другим сведениям, он получил своё название от древнеегипетского слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет этот газ. И вы уже догадались, что это вещество называется …. (аммиак)
II. Изучение нового материала
Предложите план изучения вещества (молекулярная формула - строение-свойства и получение-значение)
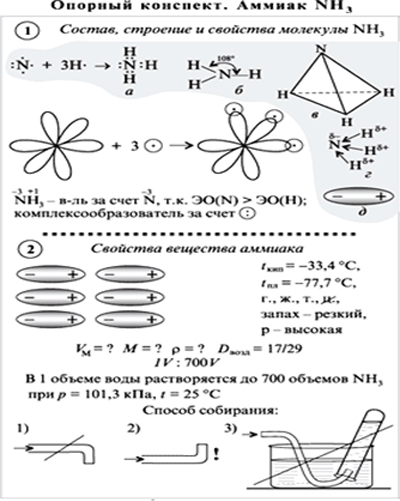
1. Состав молекулы аммиака
Выведите молекулярную формулу этого водородного соединения азота, если азота в нем 82,35%, укажите степени окисления элементов и дайте название этого соединения (решение задачи, определение СО).
Загадка 1. Имеет ли место формула NH3?
2. Строение молекулы аммиака
Изобразите молекулярную, электронную, структурную формулы молекулы аммиака, укажите вид связи (ковалентная полярная связь, одинарные)
Учитель акцентирует внимание ребят на неподеленной электронной паре атома азота, сдвиге электронной плотности в сторону гораздо более электроотрицательного атома азота и возникновении в молекуле аммиака на атоме азота частично отрицательного заряда, а на атоме водорода частично положительного.
![]()
Загадка 2. Сколько максимум связей может образовать азот с частицами водорода? И правильный ответ – не три!!!
В форме эвристической беседы учитель объясняет возможность образования четвертой связи по донорно-акцепторному механизму. Какая это связь? (за счет общих электронных пар - значит ковалентная, элементы с разной ЭО - значит полярная). Какие свойства у аммиака можете предположить за счет образования ковалентной полярной связи по донорно-акцепторному механизму? (реакции присоединения веществ, содержащих протон водорода: кислот, воды)
Загадка 3. В жидком аммиаке сравнительно высокая температура кипения аммиака (–33,4°С), не соответствующая его малой молекулярной массе (17 а.е.м), и он отлично растворяется в воде (возможно образование дополнительных связей)
Учитель знакомит учащихся с новым для них видом химической связи – водородной связью, которая возникает между молекулами аммиака и между молекулой аммиака и воды. Отмечаем особенности водородной связи (между какими частицами возникает водородная связь, сила связи, обозначение и следствие образования водородной связи в соединении)
Водородной называется связь между атомами водорода и атомами очень ЭО элементов, имеющих свободные электронные пары;
- слабее ковалентной связи в 10–20 раз;
- условно обозначается тремя точками;
- вещества с водородной связью обладают хорошей растворимостью в воде, повышается их температура кипения и плавления
3. Физические свойства аммиака
Рассчитайте относительную плотность водорода по воздуху, обсудите с соседом предположительные физические свойства аммиака. Уточните свои предположения по учебнику. Подводим итог, учитель уточняет физиологическое действие.
При нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
4. Получение аммиака
В промышленности аммиак получают прямым синтезом из простых веществ – азота и водорода. Реакция идет только в присутствии катализатора, при температуре 500 °С и повышенном давлении.
Запишите это уравнение. Дайте классификацию реакции по всем известным признакам. (Реакция соединения, экзотермическая, гомогенная, обратимая, окислительно-восстановительная, каталитическая)
В лаборатории это вещество будем получать из вещества, которое находится в черном ящике.
Загадка 4. Что в черном ящике?
Бесцветное кристаллическое вещество, которое они называли «нушадир». При растирании нушадира с гашеной известью и нагревании смеси выделялся газ с резким запахом, хорошо растворимый в воде. Алхимики заметили, что водный раствор этого газа, находясь рядом с соляной кислотой, начинал «дымить» и с течением времени все стеклянные сосуды рядом с ним покрывались белым налетом. Алхимики отметили и еще кое-что: когда раствор неизвестного газа добавляли к водному раствору медного купороса, то голубая окраска последнего становится интенсивно синей. (В ящике соль хлорид аммония).
Загадка 5. Как объяснить эти явления это будет еще одной загадкой.
Демонстрационный опыт «Получение и собирание аммиака».
При взаимодействии NH4Cl с гашеной известью - гидроксидом кальция Ca(OH)2 выделялся аммиак NH3.
2NH4Cl + Ca(OH)2 = 2 NH3 + CaCl2 +2H2O
Вспомните свойства аммиака. Как его собрать? (Собирание - в перевернутую кверху дном пробирку)
Как определить, что собирается аммиак? (запах, появление белого дыма «дыма без огня», и, учитель добавляет,- посинение влажной лакмусовой бумаги)
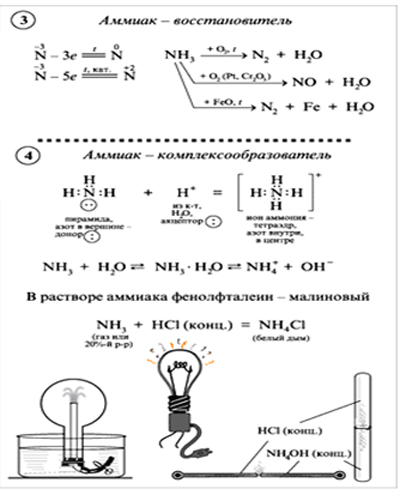
5. Химические свойства аммиака
Опреление наличия аммиака – уже объясняет некоторые химические свойства аммиака. Сделайте выводы, вспомнив строение и подтвердите уравнениями реакций.
А) взаимодействие с водой (с собранным аммиаком показываем демонстрационно «фонтанчик»)
Учащиеся делают вывод, что при растворении аммиака в воде образовалась щелочь, т.к. фенолфталеин окрасился в малиновый цвет, а лакмусовая бумажка – в синий.
NH3 + H2O <—> NH3 * H2O <—> NH4+ + OH–
Учитель демонстрирует учащимся аммиачную воду (25% раствор аммиака) и нашатырный спирт (10% раствор аммиака). Напоминает, как правильно обращаться с растворами сильно пахнущих веществ.
Б) взаимодействие с с кислотами
Учащиеся записывают уравнение, еще раз обращаем внимание на образование связи по донорно-акцепторному механизму.
NH3 + HCl —>NH4+ Cl
NH3 + H2SO4—>
В) Еще одна загадка. Аммиак горит (Демонстрационный опыт «Горение аммиака в присутствии оксида хрома (III)»), причем процесс горения представлен двумя схемами, попытайтесь определить какая схема соответствует гореню без катализатора, а какая при наличии катализатора. Расставьте коэффициенты методом электронного балланса. Укажите роль аммиака в ОВР (взаимопроверка)
NH3 + O2 → N2 + H20
NH3 + O2 → NO + H2O
Г) восстановительные свойства с оксидами металлов.
Учитывая из предыдущей реакции роль аммиака как восстановителя допишите уравнение и укажите признаки реакции.
NH3 + 3CuO = 3Cu + N2 + 3H2O
6. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Учитель предлагает учащимся самостоятельно ознакомиться с применением аммиака по схеме в учебнике.
Проводим аукцион использования аммиака
III. Рефлексия
Работа с опорным конспектом
Составьте синквейн, где первая строка «Аммиак».
Домашнее задание: параграф 29, №9-10, составить и решить задачу, включающую понятия «массовая доля кислоты в растворе, объем аммиака, расчет по избытку-недостатку», по желанию - составить кроссворд, включающий новые понятия по теме «аммиак», изобразить художественный образ аммиака.