Цель: Изучить механизм реакций разложения. Познакомиться с понятиями “катализатор”, “фермент”. Отработать навыки составлять уравнения химических реакций.
Задачи:
Образовательные:
- Повторить, скорректировать и закрепить знания по теме “Физические и химические явления”;
- Уметь записывать уравнения реакций и расставлять коэффициенты.
- Научиться определять реакции разложения.
- Рассмотреть классификацию химических реакций по определенным признакам.
- Продолжать развивать навыки самостоятельной работы, делать выводы и обобщения. 493-039
Развивающие:
- Закрепить знания учащихся о физических и химических явлениях;
- Закрепить составление уравнений химических реакций;
- Формировать умения определять реакции разложения.
- Развивать речевые навыки, познавательные способности, мышление, внимание, умение использовать изученный материал для познания нового.
Воспитательные:
- Воспитать самостоятельность, сотрудничество, нравственные качества – коллективизм, способность к взаимовыручке, адекватной самооценке.
Тип урока: комбинированный.
Оборудование:
- Презентация в PowerPoint
- Периодическая система химических элементов Д.И.Менделеева.
- Пробирки, пробиркодержатель, спиртовка, спички, растворы сульфата меди (CuSO4) и гидроксида натрия (NaOH).
- Учебник: О.С.Габриелян, Химия, 8 класс [1].
Ход урока
1. Организационный момент.
Учитель: Добрый день! В начале урока давайте вспомним с вами, какие явления существуют в природе? Приведите соответствующие примеры.
2. Актуализация знаний.
Слайд №1. Дайте определение химическим явлениям. Чем существенно отличаются два вида явлений в природе?
Ученики: Химическое явление – это явление, при котором происходит образование нового вещества, например, фотосинтез, дыхание, появление ржавчины и т.д. Меняется состав вещества.
А физическое явление – это явление, при котором новое вещество не образуется, меняется агрегатное состояние, форма вещества, например, замерзание или испарение воды, гроза, ураган и т.д.
Слайд №2.
Учитель: Как можно записать химическое явление? Что такое уравнение химической реакции?
Ученики: Химическое явление мы можем записать с помощью химических уравнений. Уравнение химической реакции – это условная запись химического явления с помощью химических формул и математических знаков.
Слайд №3.
Учитель: Химических реакций и, соответственно – уравнений химических реакций огромное количество. Сегодня мы с вами будем рассматривать определенный тип химической реакции, поговорим, какие бывают классификации химических реакций, как их можно распределить по определенным признакам в различные группы.
Слайд №4.
Учитель: Давайте запишем с вами сегодняшнее число и тему урока: “Реакции разложения”.
Слайд №5.
Учитель: Итак, цель нашего урока:
1. Рассмотреть сущность реакций разложения.
2. Продолжить формировать умение записывать уравнения химических реакций.
3. Рассмотреть понятия о скорости химической реакции и катализаторах.
3. Изучение нового материала.
Слайд №6.
Учитель: Выполните следующее задание: запишите уравнение реакции – нитрат калия разлагается на нитрит калия и кислород. Расставьте коэффициенты.
Слайд №7.
Учитель: Проверьте уравнение реакции и прочитайте ее.
Слайд №8.
Учитель: А теперь обратите внимание на реакцию с коэффициентами.
Слайд №9.
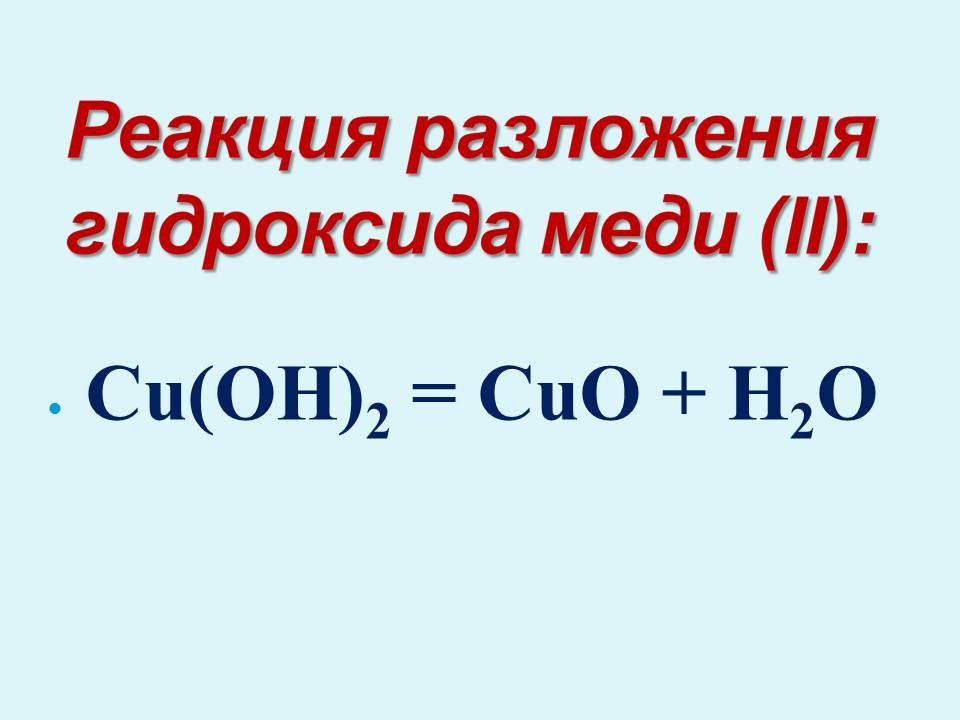
Учитель: Давайте проведем с вами реакцию разложения гидроксида меди (II) при нагревании (при проведении опыта учитель делает акцент на соблюдение техники безопасности!!!).
Запишем уравнение реакции: гидроксид меди (II) разлагается на оксид меди (II) и воду.
Слайд №10.
Учитель: Попробуйте прописать реакцию разложения гидроксида меди(II) на оксид меди (II) и воду (а один человек на доске). Проверьте реакцию. Прочитайте ее.
Слайд №11.
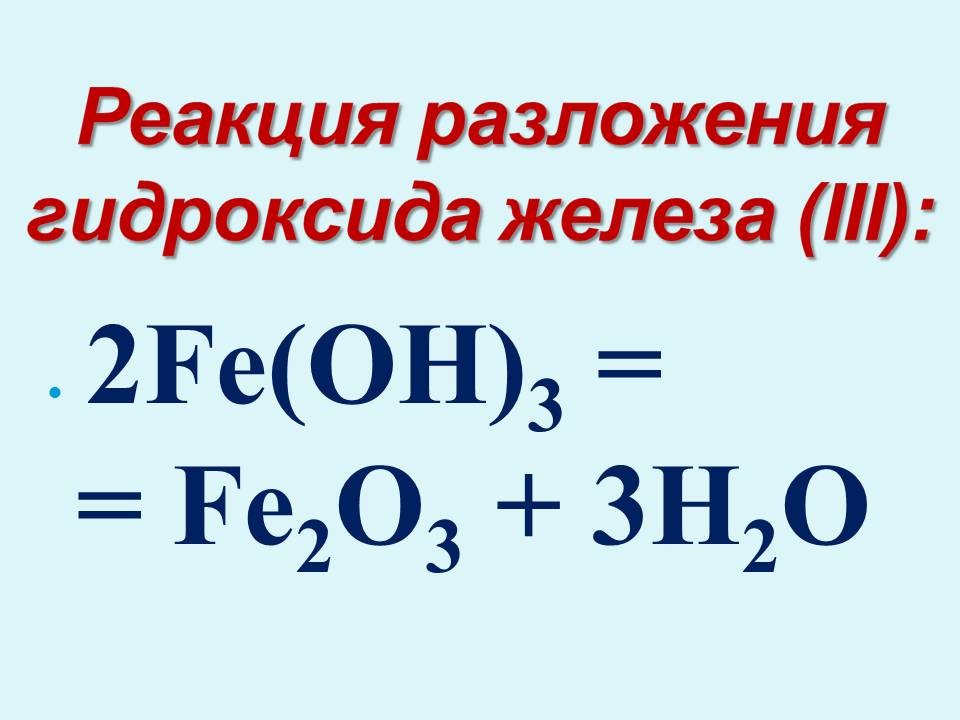
Учитель: Запишите в тетради (а один человек на доске) реакцию разложения гидроксида железа (III), зная, что при этом получатся оксид железа (III) и вода.
Слайд №12.
Учитель: Проверьте получившееся уравнение реакции, прочтите его.
Слайд №13.
Учитель: При рассмотрении всех предыдущих реакций мы говорим с вами, что вещество разлагается. Сколько веществ вступает в реакцию?
Ученики: Вступает в реакцию одно сложное вещество.
Учитель: А сколько и каких веществ получается?
Ученики: Получается несколько менее сложных веществ.
Слайд №14.
Учитель: Сделаем вывод – такие реакции и есть реакции разложения.
Слайд №15.
Учитель: Запишите определение реакции разложения в тетрадь со страницы 155 (§29).
Слайд №16.
Учитель: Что такое тепловой эффект химической реакции? Какие бывают реакции по тепловому эффекту?
Ученики: По тепловому эффекту химические реакции бывают экзотермические (идущие с выделением теплоты) и эндотермические (идущие с поглощением теплоты).
Слайд №17.
Учитель: Сегодня появляется еще одна классификация – по числу и составу исходных веществ и продуктов реакции.
Реакции разложения – это первые реакции в этой классификации.
Слайд №18.
Учитель: Запомните, все реакции разложения протекают с поглощением тепла, т.е., являются эндотермическими.
Слайд №19.
Учитель: А может ли человек управлять химической реакцией, увеличивать или уменьшать ее скорость протекания?
Ученики: Да, человек может управлять скоростью химической реакции, увеличивать ее, если будет применять специальные вещества, в биологии, например, они называются ферментами (амилаза в ротовой полости начинает расщеплять углеводы пищи).
Слайд №20.
Учитель: Еще эти вещества мы называем катализаторами. Запишите определение с доски и рассмотрите уравнение соответствующей реакции. К какому типу мы можем ее отнести?
Ученики: Это реакция разложения и каталитическая, т.е., идущая при наличии катализатора.
Слайд №21.
Учитель: Посмотрите на слайд и запишите к себе в тетрадь небольшую характеристику катализаторов.
4. Закрепление изученного материала.
Слайд №22.
Учитель: Теперь давайте с вами закрепим изученный материал и решим расчетную задачу. Условие ее представлено на слайде. Попробуйте самостоятельно прописать уравнение реакции.
Слайд №23.
Учитель: Проверьте уравнение реакции. Решаем самостоятельно задачу. По окончании урока вам надо будет сдать тетрадь на проверку. За урок вам будет выставлена оценка.
5. Домашнее задание.
Учитель: Домашним заданием вам будет следующее – параграф 29, записи в тетради, №1, страница 155 - письменно
Всем спасибо!!!
Используемая литература.
- О.С.Габриелян, Химия. 8 класс, - М.: Дрофа, 2011.