Цели: продолжить совершенствовать навыки проведения химического эксперимента практической направленности с использованием малых количеств веществ, соблюдать правила ТБ, аккуратность при выполнении работы, описывать наблюдения и делать выводы, записывать уравнения реакций в ионном виде.
Форма работы: парная.
Оборудование: на каждый стол: удобрения, стаканчики с водой, AgNO3 (раствор), КОН (конц.), ВаСI2 (раствор), 3-х литровая емкость для слива неорганичеких веществ, стеклянная палочка.
Задание. В 3-х пронумерованных пробирках находятся суперфосфат, хлорид калия, сульфат аммония. Определить каждое вещество. Записать уравнения химических реакций и разобрать их с точки зрения ТД. Задание оформить в виде таблицы.
а) К содержимому пробирок добавляем воду.
Наблюдения. В одной из пробирок вещество растворилось не полностью.
Выводы. Это суперфосфат, так как он слабо растворим.
б) К этому раствору добавляем раствор нитрата серебра.
Наблюдения: Выделяется желтый осадок.
Уравнения реакции:
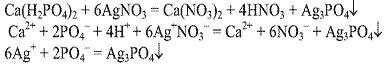
Выводы. В данной пробирке находится суперфосфат, т.к. данная реакция является качественной на фосфат - ионы.
в) К оставшимся растворам добавляем раствор хлорида бария.
Наблюдения. В одной из пробирок выпадает белый осадок.
Уравнения реакции:
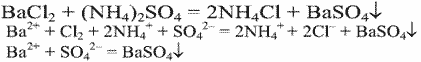
Выводы. В данной пробирке находится сульфат аммония, т.к. данная реакция является качественной на сульфат-ион.
г) К оставшемуся веществу добавляем раствор нитрата серебра .
Наблюдения. Образуется белый осадок.
Уравнения реакции:
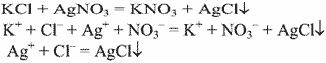
Выводы. Эта реакция является качественной на хлорид-ион поэтому в данной пробирке содержится хлорид калия.
| Чем распознаем | №1 | №2 | №3 |
| Вода | слаборастворим | хорошо растворим | хорошо растворим |
| Нитрат серебра | желтый осадок | белый осадок | |
| Хлорид бария | белый осадок | ______________ | |
| Вывод | суперфосфат | сульфат аммония | хлорид калия |