Цели урока:
- Научить учащихся описывать и характеризовать электронное строение атомов;
- Закрепить умение устанавливать причинно-следственные связи;
- Учить преодолевать трудности, учить добывать знания, думать.
Тип урока: ролевая игра-поиск.
Оборудование:
- Набор моделей электронных облаков (I и II период);
- Таблицы «Электрон», «Движение электронов в атоме», «Формы электронных орбиталей», «Электронно-волновые модели атомов I и II периода»;
- ТСО (магнитофон), аудиозапись «Шторм» в исполнении Ванессы Мэй;
- Химические термины.
Методы: проблемный, частично-поисковый, практическая работа (моделирование), обратная связь, рассказ, беседа.
Ход урока
I. Организационный момент.
1. Музыкальное вступление – звучит «Шторм» в исполнении Ванессы Мэй (3 минуты)
2. Главный объект внимания на уроке – электрон, Е ![]()
II. Усвоение новых понятий.
Д.З. – записать: §10.4, стр. 169, абз.2.
1. Назвать тему урока.
- Форма урока
- Участники урока («научные сотрудники одной из лабораторий института ядерной физики» – учащиеся; «эксперты, пресса» – гости урока)
2. Задача урока – научиться характеризовать электронное строение атомов.
3. – Что значит научиться описывать (характеризовать) электронное строение атома?
– Важнейшей характеристикой движения электронов (![]() ) на данной орбитали является энергия его притяжения ядром, или, проще – энергия его связи с ядром.
) на данной орбитали является энергия его притяжения ядром, или, проще – энергия его связи с ядром.
Е(Н)= -1300 кДж; Почему «-»? Найти в учебнике, с. 170, 1 абзац.
Е(Н)= -2400 кДж/моль (а не (-1300)х2=-2600)
См. рис. 10.5
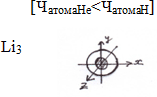
Е(Li)= -7000кДж/моль – это 2 первых ![]() .
.
Е(Н)= -520 кДж/моль – это 3-й ![]() , значит 3-й
, значит 3-й ![]() находится на другом энергетическом уровне.
находится на другом энергетическом уровне.

Проводится физминутка.
Атом Н → 1 электрон находится на 1S-орбитали (1 – номер уровня, S – название орбитали)
Атом Не → 2 электрона находятся на той же 1S-орбитали.
Атом Li 2 электрона находятся на 1S-орбитали и 1 электрон на 2S-орбитали
Атом В2
Атом В?
Физминутка
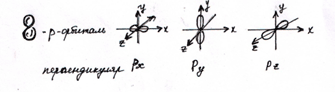
Правило: на каждой р-орбитали (как и на S-орбитали и любых других) может находиться не более 2 электронов (!)
Вывод:
- На 1 уровне может быть только 2
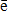
- на 2 уровне может быть только 8
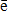 (2
(2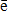 на 2S-орбитали, 6
на 2S-орбитали, 6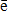 на 2р-орбитали)
на 2р-орбитали)
Моделирование атомов элементов: В, С, N, O, F, Ne.
Распределение ![]() в атоме Ne (10 электронов) можно записать следующей формулой:
в атоме Ne (10 электронов) можно записать следующей формулой:
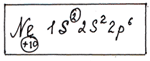
где 1 – номер уровня, 1S – орбиталь, 2 – число электронов.
4. Запишем электронные формулы описанных выше атомов:
На доске – таблица:
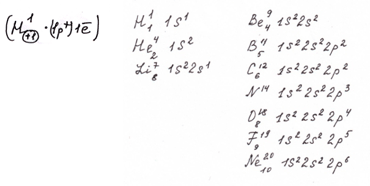
III. Формирование умений и навыков.
1. Упражнение 4с стр.173
2. Как распределяются в атоме Na, Mg, Al?
IV. Итог урока.
- Электроны бывают двух видов (s- и p-) и распадаются на s- и p- обр.
- Электроны распределяются по энергетическим уровням.
- Электрон в атоме можно выразить формулой.