Тип урока: урок изучения нового материала.
ТДЦ:
- Образовательный аспект:
- создать условия для выявления причинно-следственных связей между составом, строением и свойствами веществ.
- способствовать формированию представлений о механизмах химических реакций.
- Развивающий аспект:
- на примере карбоновых кислот совершенствовать умение учащихся подтверждать химические свойства уравнениями реакций.
- продолжить формирование умения применять знания, полученные при изучении неорганической химии для характеристики свойств органических соединений
- создать условия для развития умения доказывать общее в строении и свойствах неорганических и органических кислот
- способствовать совершенствованию умений учащихся самостоятельно проводить опыты полумикрометодом.
- Воспитательный аспект:
- способствовать пониманию единства органического и неорганического мира
- воспитывать уважительное отношение друг к другу.
- способствовать формированию культуры умственного труда, умения слушать, общаться, наблюдать и делать выводы, соблюдения правил обращения с веществами.
Методы обучения: репродуктивный, частично-поисковый, практический.
Формы организации познавательной деятельности: парная, индивидуальная, фронтальная.
Целеполагание и мотивация.
На прошлом занятии мы изучали с вами ….
(добавляют ученики) – карбоновые кислоты: их
состав и строение, классификацию и номенклатуру.
И сегодня нам с вами предстоит изучить
(предложить учащимся самостоятельно выявить
цель занятия) свойства карбоновых кислот на
основе их строения и знаний, полученных при
изучении неорганических кислот.
Цели урока (повторяются и корректируются
учителем): изучить химические свойства
карбоновых кислот на примере уксусной и сравнить
эти свойства с неорганическими кислотами;
выявить особые свойства карбоновых кислот,
которые не изучались в неорганической химии.
Уметь подтверждать свойства уравнениями
реакций. Знание химических свойств вам
пригодятся в повседневной жизни: приготовление
теста – гашение соды уксусом, нейтрализация
щелочных растворов кислотами, соли высших
карбоновых кислот используют для приготовления
мыла.
Актуализация: Для этого вспомним, каково же строение предельных монокарбоновых кислот.
Рисунок формулы на доске. Стрелки рисуются в ходе обсуждения вопросов.
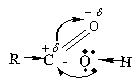
Какие группы выделяются в молекуле
карбоновой кислоты? – карбонильная и
гидроксильная группы.
Как изменяется полярность в карбонильной
группе? – смещение электронной плотности от
углерода к кислороду – это смещается Пи-связь.(-М)
Что происходит между карбонильным углеродом
и кислородом гидроксильной группы? –
электронная пара атома кислорода смещается к
менее электроотрицательному атому углерода.
К чему приводит такое смещение? – атом
водорода гидроксильной группы становится
подвижным и отрывается от молекулы кислоты.
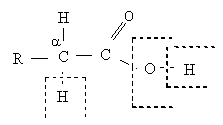
Для монокарбоновых кислот характерна высокая реакционная способность:
- Разрыв связи О-Н реакция обусловлена подвижностью атома водорода гидроксильной группы.
- Разрыв связи С-О реакция замещения гидроксильной группы.
- Разрыв связи С-Н у α-углеродного атома реакции замещения с участием радикала.
Домашнее задание: §30 стр.191-193 упр.2,3
Упражнения будут подобны заданиям, проделанным в
классе. Учебник «Органическая химия» 10 класс
(профильный уровень) Н,Е.Кузнецова, И.М.Титова,
И.Н.Гара; Москва «Вентана-Граф» 2005
Тетради после урока соберу, чтобы проверить
качество выполненных заданий и выявить, если
будут характерные недочеты для дальнейшей
коррекции знаний и умений.
Изучение нового материала с одновременным первичным закреплением учебного материала. Приложение 1 (Технологическая карта урока)
Рассмотрим первую группу реакций.
Реакции на разрыв связи О-Н – замещение атома
водорода (Н)
Вспомните, какие химические свойства
характерны для соляной кислоты? – с металлами
до Н, с основными оксидами, с основаниями, с
солями слабых кислот.
Проверьте, обладает ли уксусная кислота этими
же свойствами? Для этого проведите
лабораторные опыты не только с уксусной
кислотой, но и с соляной. Сравните результаты
опытов и сделайте вывод.
ТБ при работе с кислотами и щелочами:
Знать: при попадании на кожу вызывают ожоги.
Необходимо смыть проточной водой, если кислота –
нейтрализуют раствором соды, а если щелочь –
слабым раствором борной или уксусной кислоты.
Склянки с растворами кислот и щелочей сразу
закрывать и ставить в ящик
Пластинки для проведения опытов
полумикрометодом придерживать (легкие), при
необходимости смыть в кристаллизатор при помощи
промывалки
Стеклянные трубочки после опытов отпускать в
стакан с водой
Работа проходит в паре: один проводит реакции с
соляной кислотой, другой – с уксусной. Уравнения
записывать только для уксусной кислоты,
сравнивая записями уравнений соляной кислоты
в таблице. Для проведения опытов рекомендую в
пластинки ячеек положить необходимые реактивы, с
которыми реагируют кислоты:
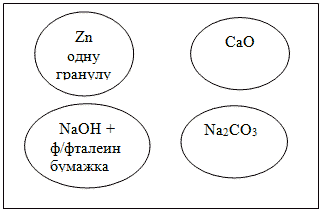
Затем добавить кислоту с помощью стеклянной
трубочки.
Совет: для лучшей эффективности сравнения
опыты с той и другой кислотой проводить
одновременно
Какая кислота на ваш взгляд наиболее активна?
Почему?
– Реакции с соляной кислотой идут быстрее,
значит она более сильная кислота.
Записываем в тетрадь вывод. Органические кислоты
вступают в реакции характерные для
неорганических кислот, но они менее активные.
Допишите уравнения реакций для уксусной
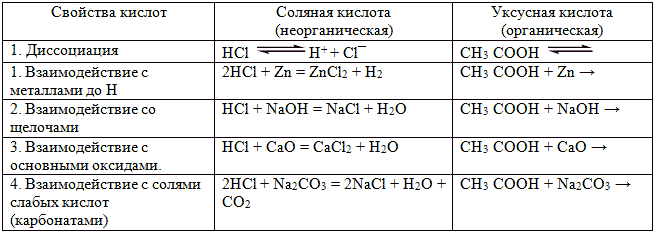
кислоты, используя данные таблицы
Сравнение химических свойств соляной и уксусной
кислот.
Рассмотрим вторую группу реакций.
Реакции на разрыв связи С-О – замещение гидроксильной группы (ОН)
1. Взаимодействие со спиртами с образованием сложных эфиров
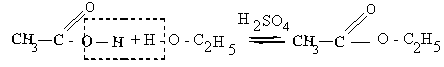
2. Взаимодействие с галогенидами фосфора PCl5, PCl3
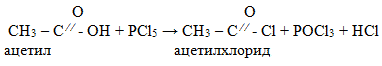
3. Межмолекулярная дегидратация карбоновых кислот до ангидридов – это производные карбоновых кислот, состоящие из двух кислотных радикалов (ацилов) соединенных через кислород.
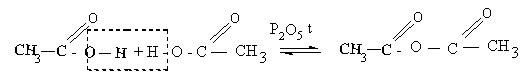
Закрепление. Запишите уравнения реакций для пропионовой кислоты с этиловым спиртом, с хлоридом фосфора (V) и реакцию межмолекулярной дегидратации.
Рассмотрим третью группу реакций.
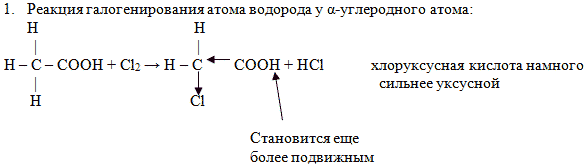
Реакции на разрыв связи С-Н у α-углеродного атома – реакции замещения с участием радикала.
1. Реакция галогенирования атома водорода у α-углеродного атома:
Рефлексия.
Запишите самостоятельно общий вывод о свойствах карбоновых кислот.
Вывод:
- карбоновые кислоты проявляют общие свойства для всех кислот по связи О-Н;
- специфические свойства по связи С-О при этом замещается группа О-Н;
- возможны реакции замещения атомов водорода у α-углеродного атома с образованием более сильных карбоновых кислот.