Цели: cформировать у учащихся основные представления о фосфоре и его соединениях. Создать условия для развития навыков самостоятельной работы, умения анализировать, делать выводы, обобщать имеющиеся знания и применять их в новых ситуациях.
Дидактические задачи.
- Повторить строение атома фосфора и сравнить его строение со строением атомов азота и серы.
- Рассмотреть кислородсодержащие соединения фосфора: оксид фосфора (V), ортофосфорную кислоту и ее соли.
Развивающие задачи/
- Развитие логического мышления, умение выделять главное.
- Развитие зрительного анализатора при работе с учебником, периодической системой и таблицей растворимости.
- Развитие навыка самостоятельной работы
- Совершенствование умение составлять реакции ионного обмена, умение отражать сущность ОВР.
Воспитательные задачи.
Содействовать воспитанию взаимопомощи, культуры общения, способствующей созданию благоприятного психологического климата, настойчивости в достижении поставленной цели.
I. Проверка домашнего задания.
Работа с тестом. (Cлайд 2-10). Презентация
1. Фосфор находится:
1) в V группе, побочной подгруппе;
2) в III группе, главной подгруппе;
3) в V группе, главной подгруппе;
4) в III группе, побочной подгруппе.
2. Фосфор имеет степени окисления:
1) -3, +2, +5; 2) +5, +3, -3; 3) -5, -3, +3; 4) -2, +3, +5.
3. Электронное строение атома фосфора:
1) 1s22s22p3; 2) 1s22s22p63s23p3; 3) 1s22s22p5; 4) 1s22s22p63s23p5.
4. Число неспаренных электронов в атоме фосфора равно:
1) 1; 2) 3; 3) 5; 4) 7.
5. У атома фосфора число электронов на внешнем энергетическом уровне и заряд ядра равны соответственно:
1) 7 , 14; 2) 4 , 14; 3) 3 , 15; 4) 5 , 15;
6. Высший оксид состава Э2О5 образуют все элементы:
1) VII А группа; 2) VI А группа; 3) V А группа; 4) IV А группа.
7. Химический элемент распложен в 3 периоде V А группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2, 8, 4; 2) 2, 8, 18, 5; 3) 2, 8, 2; 4) 2, 8, 5.
8. Верны ли следующие суждения об элементах VА группы?
А. С возрастанием заряда ядра радиус атома увеличивается.
Б. Общая формула летучего водородного соединения RН3
1) верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
9. Электроотрицательность элементов уменьшается в ряду:
1) H, Br, F; 3) P, S, Сl;
2) Te, Se, S; 4) N, P, As.
10. Степень окисления -3 фосфор проявляет в соединении
1) PH3; 2) P2O3; 3) P2O5; 4) H3PO4.
11. Схема превращения, в которой фосфор является окислителем:
1) P+5 ------ P0; 3) P0 ------- P+3;
2) P-3 ------- P0; 4) P+3 ------- P+5.
12. Схема превращения, в которой фосфор является восстановителем:
1) P0 ------ P-3; 3) P+5 --------- P0;
2) P0 ------- P+5; 4) P+5 --------- P+3.
13. В ряду химических элементов N ---- P ---- As
1) высшая степень окисления не изменяется;
2) радиус атома уменьшается;
3) число электронов на внешнем уровне увеличивается;
4) окислительные свойства простых веществ ослабевают;
5) заряд ядра атома уменьшается.
Ответ _______________ (найдите два верных ответа)
14. В ряду химических элементов Si ----- P ----- S УВЕЛИЧИВАЕТСЯ
1) радиус атома;
2) высшая степень окисления;
3) валентность элемента в летучем водородном соединении;
4) число заполненных электронных слоев;
5) кислотный характер высшего оксида.
Ответ _______________ (найдите два верных ответа)
II. Фронтальная беседа.
Через фронтальную беседу происходит объяснение нового материала (слайды №11-16).
1. Что такое аллотропия?
2. Чего больше в природе: простых веществ или химических элементов?
3. Какие аллотропные модификации образует фосфор?
4. Одинаковые или разные продукты получаются при горении красного и белого фосфора?
5. Запишите уравнение реакции горения фосфора.
а) Расставьте степени окисления каждого элемента в уравнении реакции,
б) Составьте электронный баланс
в) Укажите окислитель и восстановитель, процессы окисления и восстановления.
6. Какой характер химических свойств проявляет оксид фосфора (V)?
7. Что образуется, если растворить оксид фосфора (V) в воде?
8. Запишите уравнение химической реакции.
9. Является ли эта реакция окислительно – восстановительной? Почему?
10. Дайте характеристику ортофосфорной кислоте :
- По количеству атомов водорода
- По содержанию атомов кислорода
- По силе кислоты
11. Запишите уравнение диссоциации ортофосфорной кислоты
12. Какие кислотные остатки получаются при диссоциации этой кислоты?
13. Ортофосфорная кислота образует три ряда солей. Например, запишите уравнение реакции взаимодействия (к доске вызываются учащиеся, которые записывают соответствующие уравнения химических реакций) :
- 1 моль ортофосфорной кислоты и 1 моль щелочи.
- 1 моль ортофосфорной кислоты и 2 моль щелочи
- 1 моль ортофосфорной кислоты и 3 моль щелочи
В первом случае получается кислая соль дигидрофосфат, во втором случае – кислая соль гидрофосфат, в третьем случае – средняя соль фосфат.
14. Запишите последнюю реакцию в полнм ионном и кратком ионном виде. (учащийся выполняет задание у доски).
15. Качественная реакция на фосфат-ион.
Качественной реакцией на фосфат-ион является взаимодействие его с растворимой солью серебра. Какая соль серебра растворима?
Данный эксперимент можно провести как демонстрационный или как лабораторный опыт.
16. Запишите реакцию взаимодействия фосфата с нитратом серебра в молекулярном, полном и кратком ионном виде. (Учащийся выполняет задание на доске).
III. Закрепление изученного материала. (Cлайд №17)
1. Дана схеме превращений:
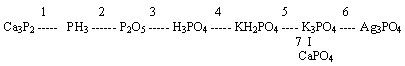
Для второй реакции составьте электронный баланс, укажите окислитель и восстановитель. Процессы окисления и восстановления.
7-ю реакцию запишите в ионном виде.
Можно предложить закончить цепочку дома, если на уроке не будет хватать времени.
IV. Домашнее задание.
Рудзитис Г.Е. Химия-9 (слайд 18)
I. $ 22, задача №4, стр.70 (задача на массовую долю вещества в растворе подобная С2-ГИА)
II. Задание обязательное для выполнения учащимися, которые собираются сдавать химию в формате ГИА, для остальных учащихся – по желанию.
Задача. Твердое вещество белого цвета хорошо растворимо в воде. Его раствор окрашивает индикатор лакмус в красный цвет. Если к раствору этого вещества добавить раствор нитрата серебра, то образуется осадок желтого цвета. Определите исследуемое вещество. Составьте два уравнения проведенных реакций (взаимодействие раствора вещества с раствором индикатора не учитывать при написании реакций).
Список литературы:
- Гара Н.Н. Химии. Рабочие программы. Предметная линия учебников. Г.Е.Рудзитис, Ф.Г.Фельдман. 8-9 классы. Пособие для учителей общеобразовательных учреждений, М.: Просвещение, 2011, 46 c.
- Денисова В.Г. (составитель) Мастер-класс учителя химии. Выпуск 2. Химия элементов. Уроки с использованием ИКТ. Интерактивные игры. Методическое пособие с электронным приложением. –М.: Планета, 2011. -240 с. (Современная школа).
- Добротин Д.Ю., Каверина А.А., Гончарук О.Ю. Государственная итоговая аттестация выпускников 9 классов в новой форме. Химия.2012. Учебное пособие. – М.: “Интеллект –Центр”, 2012. -176 с.
- Рудзитис Г.Е. Химия : неорганическая химия. Органическая химия : учеб. для 9 класса общеобразоват. учреждений. - 12-е изд., перераб. -М.: Просвещение, 2009. -191 с.
- Солдатова Т.М. Уроки химии с применением информационных технологий. Неметаллы. 9 класс: Разработки уроков, задания для подготовки к ГИА и ЕГЭ, задачи и решения. Методическое пособие с электронным приложением. – М.: Планета, 2011. – 240 с. (Современная школа) .
- Химия. Подготовка к ГИА 9 в 2013 году. Диагностические работы. – М.: МЦНМО, 2013. -64 с.
- Химия. Диагностические работы в формате ГИА 9 в 2012 году.- М.: МЦНМО, 2013. -60 с.