Цели урока:
- раскрыть понятие физической природы электрического тока в жидкостях, опытное подтверждение электронной теории;
- продолжить формирование естественно-научных представлений по изучаемой теме;
- создать условия для формирования познавательного интереса, активности учащихся;
- формирование адаптивной системы обучения;
- формирование креативного мышления;
- формирование коммуникативного мышления.
Оборудование: интерактивный комплекс SMART Board Notebook, локальная сеть компьютеров, Интернет.
Метод ведения урока: комбинированный.
Эпиграф урока:
Жизнь ставит цели науке; наука освещает
путь жизни.
Н.К. Михайловский
План урока:
I. Оргмомент.
II. Работа в группах.
III. Обсуждение итогов, монтаж презентации.
IV. Рефлексия.
V. Домашнее задание (Г.Я. Мякишев “Электродинамика” 10-11 класс, 3.4-3.6).
Ход урока
- Добрый день! Садитесь.
Сегодня наша работа будет происходить по группам.
Задания группам:
- Природа электрического тока в растворах и расплавах электролитов
- Электролиты. Электролитическая диссоциация
- Опыт Фарадея по электролизу
- Закон Фарадея
- Вольт – амперная характеристика тока в жидкостях. ЭДС поляризации
- Применение электролиза
Содержание задания групп:
Электрический ток в электролитах. Законы Фарадея для электролиза
Электрический ток в электролитах обусловлен движением положительных и отрицательных ионов. В растворах солей, щелочей, кислот происходит распад молекул на ионы – электролитическая диссоциация. Из-за взаимодействия с полярными молекулами воды молекулы растворяемых веществ распадаются на разноименные заряженные “осколки” - ионы. Положительно заряженными оказываются ионы металлов и водорода, а отрицательно заряженными – кислотные остатки и гидроксильная группа (ОН).
Рассмотрим этот процесс на примере бромида калия KBr.
Взаимодействие атомов брома и калия в молекуле бромида калия упрощенно можно представить как взаимодействие двух ионов: положительного заряженного иона К+ и отрицательно заряженного Br-. Объясняется это тем, что единственный валентный электрон у калия слабо связан с атомом. При образовании молекулы KBr можно схематически изобразить в виде диполя. (рис 1). При растворении соли бромида калия в воде молекулы KBr попадают в окружение молекул воды, которые тоже являются диполями. В электрическом поле, создаваемой молекулой KBr, молекулы вды ориентируются, как показано на рисунке 2. при этом они растягивают молекулу KBr настолько, что незначительная встряска при столкновении с другими молекулами, участвующими в тепловом движении, разрушает ее. Часть молекул KBr распадаются – диссоциирует на ионы K+ и Br-.
Степень диссоциации, т.е. доля молекул растворенного вещества, которые распадаются на ионы, зависит от температуры, концентрации раствора и диэлектрической проницаемости растворителя. С увеличением температуры степень диссоциации возрастает и, следовательно, увеличивается концентрация положительно и отрицательно заряженных ионов.
Наряду с процессом диссоциации в растворах электролитов происходит и обратный процесс. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать. При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время вновь воссоединяются в нейтральные молекулы. При наступлении динамического равновесия концентрация ионов (при неизменной температуре).
Ионная проводимость растворов и расплавов электролитов
При отсутствии внешнего электрического поля ионы вместе с нераспавшимися молекулами находятся в хаотическом тепловом движении.
Если сосуд с раствором электролита включить в электрическую цепь, то между электродами образуется электрическое поле, и ионы в растворе придут в упорядоченное движение (рис.3). положительно заряженные ионы станут двигаться по направлению напряженности поля, т.е. к катоду, а отрицательно заряженные ионы – в противоположном направлении, т.е. к аноду.
Отрицательные ионы, пришедшие к аноду и называемые, поэтому анионами, отдают свои лишние электроны аноду, а посредством его и соединительных проводников – положительному полюсу источника, возмещая на нем недостаток электронов. Положительные ионы, пришедшие к катоду и потому называемые катионами, получают недостающие им электроны из избытка их на катоде. Так устанавливается во внешней цепи перемещение электронов от отрицательного полюса источника тока к положительному. При этом через раствор электролита заряд переносится вместе с частицами вещества – ионами. Такую проводимость называют ионной. В расплавах электролитов проводимость так же ионная, так как при плавлении твердых электролитов их молекулы распадаются на положительные и отрицательные ионы. Жидкие же металлы обладают электронной проводимостью.
Электролиз
При прохождении электрического тока через раствор электролита анионы отдают свои лишние электроны на аноде, а катионы на катоде получают недостающие электроны. Таким образом, на электродах при прохождении через раствор электрического тока происходит выделение веществ, входящих в состав электролитов.
Процесс выделения на электролитах вещества, связанный с окислительно-восстановительными реакциями, называют электролизом.
В ряде случаев нейтрализуемые на электродах ионы вступают в химические реакции с растворителем, растворенными веществами или с веществами электродов. Эти реакции называют вторичными.
Так, например, при электролизе раствора медного купороса (CuSO4) на катоде выделяется медь, а на аноде – кислотный остаток SO4., который вступает в реакцию с веществом анода – медью : Cu + SO4 = CuSO4
Благодаря этой реакции концентрация раствора медного купороса остается неизменной. Происходит лишь перенос меди с анода на катод, пока анод полностью не израсходуется.
В случае платинового анода при электролизе раствора медного купороса происходит реакция с растворителем: 2SO4 + 2Н2О —> 2Н2SO4 + О2.
Молекулы серной кислоты попадают в раствор, а молекулярный кислород выделяется в виде пузырьков.
Закон Ома

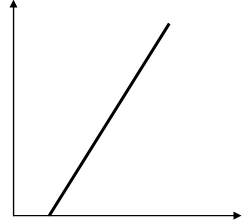
Для растворов электролитов справедлив закон Ома. При постоянной температуре графиком, выражающим зависимость силы тока от напряжения (вольт-амперная характеристика) для растворов электролитов, является прямая линия. Эта прямая не проходит через начало координат, а “сдвинута” вправо. Это объясняется тем, что при электролизе происходит поляризация электродов, погруженных в раствор электролита, причем ЭДС поляризации имеет знак, противоположный знаку напряжения на электродах.
Закон электролиза
Масса выделившегося вещества равна произведению массы одного иона на число ионов, осевших на электроде за время t:
m=m0i·Ni (1)- масса выделенного вещества, где m0i - масса иона, Ni - число ионов.
Масса иона равна m0i=M/NA (2)- масса иона, где M - молярная (атомная) масса, NA - постоянная Авогадро.
Число ионов, осевших на электроде, Ni=![]() q/q0i (3)- число
ионов, где
q/q0i (3)- число
ионов, где ![]() q=I·
q=I·![]() t - заряд, протекающий
через электролиз за
t - заряд, протекающий
через электролиз за ![]() t,
t,
q0i=n·e (e - элементарный заряд).
При диссоциации молекул, состоящих из одновалентных атомов, возникают однозарядные ионы.
Подставляем в (1) формулу выражения (2) и (3),
учитывая, что ![]() q=I·
q=I·![]() t, q0i=ne:
t, q0i=ne:
m=M/(n·e·NA)· I·![]() t.
t.
Закон Фарадея

М. Фарадей
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе: Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
m = kQ = kIt
Величину k называют электрохимическим эквивалентом. Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:
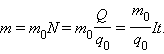
Здесь m0 и q0 – масса и заряд одного иона – число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0. Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде
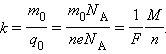
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества, F = eNA –постоянная Фарадея.
F = eNA = 96485 Кл / моль.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества. Закон Фарадея для электролиза приобретает вид:
![]()
Технические применения электролиза
Гальваностегия — покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, серебрение, золочение и т.д.) с целью предохранения от окисления и придания изделию привлекательного внешнего вида. Предмет, подлежащий покрытию, тщательно очищают, хорошо обезжиривают и помещают в качестве катода в электролитическую ванну, содержащую раствор соли того металла, которым должен быть покрыт данный предмет (рис. 3.8). Анодом служит пластинка из того же металла. Для более равномерного покрытия обычно применяют две пластинки в качестве анода, помещая предмет между ними.
Гальванопластика — электролитическое изготовление копий с рельефных предметов (медалей, гравюр, барельефов и т.д.). С рельефного предмета делают восковый или иной слепок. Затем поверхность слепка покрывают тонким слоем графита, чтобы она стала проводящей. В таком виде слепок используется в качестве катода, который опускают в электролитическую ванну с раствором медного купороса. Анодом служит медная пластинка. Когда на слепке нарастет достаточно толстый слой меди, электролиз прекращают и воск осторожно удаляют. Остается точная медная копия оригинала.
В полиграфической промышленности такие копии (стереотипы) получают с оттиска набора на пластичном материале (матрица), осаждая на матрицах толстый слой железа или другого материала. Это позволяет воспроизвести набор в нужном количестве экземпляров. Если раньше тираж книги ограничивался числом оттисков, которые можно получить с одного набора (при печатании набор стирается), то использование стереотипов позволяет значительно увеличить тираж.
Правда, в настоящее время с помощью электролиза получают стереотипы только для книг высококачественной печати и с большим числом иллюстраций.
Осаждая металл на длинный цилиндр, получают трубы без шва.
Процесс получения отслаиваемых покрытий был разработан русским ученым Б. С. Якоби, который в 1836 г. применил этот способ для изготовления полых фигур для Исаакиевского собора (в Санкт-Петербурге).
Рафинирование меди
Медь является лучшим материалом для изготовления проводников, но для этого она должна быть лишена каких бы то ни было примесей. Очищение меди от примесей называется рафинированием (очисткой) меди. Массивные куски (толстые листы) неочищенной меди, полученной при выплавке из руды, являются анодом, а тонкие пластинки из чистой меди — катодом. Процесс происходит в больших ваннах с водным раствором медного купороса. При электролизе медь анода растворяется; примеси, содержащие ценные и редкие металлы, выпадают на дно в виде осадка (шлама), а на катоде оседает чистая медь. Таким же образом производят рафинирование некоторых других металлов.
Получение алюминия
При помощи электролиза получают алюминий. Для этого подвергают электролизу не растворы солей этого металла, а его расплавленные оксиды.
В угольные тигли (рис. 3.9) насыпают глинозем (оксид алюминия Аl2O3), полученный путем переработки бокситов — руд, содержащих алюминий. Тигель служит катодом. Анодом являются угольные стержни, вставленные в тигель. Сначала угольные стержни опускают до соединения с тиглем и пропускают сильный ток. Глинозем при прохождении тока нагревается и расплавляется. После этого угли поднимают, ток проходит через жидкость и производит электролиз. Расплавленный алюминий, выделяющийся при электролизе, опускается на дно тигля (катод), откуда его через особое отверстие выпускают в формы для отливки.
Описанный способ получения алюминия сделал его дешевым и наряду с железом самым распространенным в технике и быту металлом.
Путем электролиза расплавленных солей в настоящее время получают также натрий, калий, магний, кальций и другие металлы.
Электролиз используется для гальваностегии, гальванопластики, рафинирования меди, получения алюминия и др.
- Молодцы, ребята! Вы отлично справились с заданиями. У нас получилась хорошая презентация. Спасибо за урок.