Цель: требующие применения комплексных мыслительных операций.
Образовательные задачи:
- сформировать у учащихся умения давать характеристику химическому элементу на основании положения его в Периодической системе Д.И. Менделеева и строения атома на примере элемента неметалла – серы;
- применять полученные знания о физических и химических свойствах серы, нахождении в природе и применении соединений серы, химизме производстве серной кислоты;
- сформировать навыки решения расчётных задач.
Методы и приемы: монологическое и диалогическое изложение материала, эвристическая беседа.
Стратегия обучения: пояснительно-эвристическая, алгоритмическая.
Тип учебной деятельности: репродуктивная, продуктивная, творческая.
Средства обучения: мультимедийный проектор, компьютер, коллекция минералов, учебная литература: «Химия. 9 класс», авторы – Л.С. Гузей, В.В. Сорокин, Р.П. Суровцева – М.: Дрофа, 2002.
Ведущая роль: учитель – ученик.
Оборудование и реактивы: образцы серы и её соединений
ХОД УРОКА
I. Организационный этап
- Готовность к уроку;
- Психо-эмоциональный настрой
– Ребята, у вас на парте есть у каждого три вида смайликов, которые отражают ваше настроение, покажите, пожалуйста, ваше настроение!
 |
 |
 |
(Учащиеся показывают своё настроение, в том числе и учитель)
II. Сообщение темы и целей урока
– Сегодня мы с вами начинаем изучать новую
главу: «Химия элементов – неметаллов» (слайд 1).
– Давайте вспомним несколько металлов с помощью
загадок (слайд 3).
- Красив в кристаллах и парах, на детей наводит страх.
- Белый, воздуха боится, покраснел чтоб сохраниться.
- Хоть многие вещества превращает в яд, в химии она достойна всяческих наград (слайд 2).
- Гость из космоса пришёл, в воздухе приют себе нашёл.
- Какой газ утверждает, что он – это не он?
- Какой неметалл является лесом?
– Сегодня мы с вами познакомимся с неметаллом «Сера», мы узнаем физические свойства серы, получение серы, нахождение в природе а также эффективность использования сырья.
Сера – химический элемент.
– Мы вместе попробуем дать краткую характеристику химическому элементу – сера, по плану (слайд 4).
- Каков химический знак?
- В какой группе периодической системы находится?
- В каком периоде находится?
- Какой атомный номер?
- Какая относительная атомная масса?
- Сколько электронов в атоме? Как располагаются электроны на АО?
- Какая электронная формула серы?
- Какие низшая (в соединениях с водородом и металлами) и высшая (в соединении с кислородом) валентности серы?
(Ответы этих вопросов записываются у доски и в тетрадях).
– А где встречается сера в природе? На этот вопрос ответят нам ваши коллеги, которые подготовили дополнительную информацию.
Ученик 1 (слайд 5): Сера самородная,
минерал из класса самородных
элементов. Самородная сера жёлтого цвета, при
наличии примесей – бурая до чёрной; содержит
включения битумов, карбонатов, сульфатов, глины.
Блеск смолистый до жирного, хрупкая, плавится при
температуре 119°С; загорается при температуре
214-465°С.
Главные типы месторождений самородной серы –
вулканогенные и экзогенные. Экзогенные
месторождения самородной серы преобладают; они
связаны с гипсо-ангидритами, которые под
воздействием выделений углеводородов и
сероводорода восстанавливаются и замещаются
серно-кальцитовыми рудами. Геохимические
процессы образования самородной серы
существенно активизируются микроорганизмами
(сульфатредуцирующими и тионовыми бактериями).
Среди вулканогенных месторождений самородной
серы главное значение имеет Япония, образованные
сероносными кварцитами и опалитами, и
вулканогенно-осадочные сероносные илы кратерных
озёр.
Ученик 2 (слайд 6): Мирабилит(от
лат. mirabilis – удивительный; назван немецким
химиком И.Р.Глаубером),
глауберова соль, минерал из класса сульфатов,
химический состав Na2[SO4] х 10H2O.
Кристаллы мирабилита моноклинной системы,
коротко призматические до игольчатых. М. также
образует зернистые или порошковатые агрегаты и
мелкокристаллические корочки. Легко растворим в
воде, раствор обладает горько-солёным вкусом. В
сухом виде быстро теряет воду и переходит в белый
порошковидный безводный минерал – тенардит
(Na2SO4). Встречается в соляных озёрах,
мелководных заливах и горячих источниках;
образует также выцветы на почве.
Мирабилит используется главным образом в
химической промышленности для получения соды,
едкого натра, в стекольной, красочной и других
отраслях промышленности, а также в медицине.
Ученик (слайд 7): Пирит (греч.
pyrites lithos, буквально – камень, высекающий огонь, от
pyr – огонь; название связано со свойством пирита
давать искры при ударе), серный колчедан,
железный колчедан, минерал химического состава
FeS2 (46,6% Fe, 53,4% S). Нередки примеси Со, Ni, As, Cu, Au,
Se и др.
Пирит кристаллизуется в кубической системе,
образуя кубические кристаллы; распространён
чаще всего в виде сплошных зернистых масс. Цвет
светлый, латунно-жёлтый; блеск металлический.
Пирит распространён наиболее широко в
месторождениях гидротермального происхождения,
колчеданных залежах в которых сосредоточены
главные массы этого минерала. Пирит является
сырьём для получения серной кислоты, серы и
железного купороса. Месторождения пирита
имеются на Урале, Алтае, в Казахстане,
Закавказье и др. районах; за рубежом – в Норвегии,
Испании (Рио-Тинто), Италии, на острове Кипр, в США,
Канаде, Японии.
Ученик 4 (слайды 8,9): Сера – жизненно важный химический элемент. Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей и выпадение волос. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца.
– Мы познакомились с природой серы, а сейчас узнаем, какими физическими свойствами обладает сера. Сера обладает следующими физическими свойствами (учащиеся знакомятся с образцами серы):
- Твёрдое кристаллическое вещество желтого цвета, без запаха.
- Как и все неметаллы плохо проводит теплоту и не проводит электрический ток.
- Порошок серы всплывает в воде.
- Сера в природе практически не растворяется.
- Температура плавления 120°С (слайд 10).
Серу применяют для производства серной
кислоты, вулканизации каучука, как фунгицид в сельском
хозяйстве и как сера коллоидная – лекарственный
препарат. Также сера в составе серобитумных
композиций применяется для получения
сероасфальта, а в качестве заместителя
портландцемента – для получения серобетона
(слайд 11).
Химизм производства серной кислоты протекает в 3
стадиях (слайд 12):
(Учащиеся записывают уравнения)
I стадия производства – обжиг:
S + O2 = SO2 + 297 кДж
4FeS2 + 11O2 = 8SO2 + 2Fe2O3 +
3400кДж
При горении серы и обжиге сульфидных руд
развивается столь высокая температура, что оксид
серы (VI) оказывается неустойчивым и поэтому не
образуется. В этих реакциях получается SO2.
Но в серной кислоте H2SO4 сера
шестивалентна, следовательно, для ее получения
нужен оксид серы (VI) SO3. Чтобы ее получить,
надо окислить SO2, т.е. провести реакцию, но
при более низкой температуре, чем та, которая
развивается при горение серы или обжиге
сульфидной руды.
II стадия производства – окисление сернистого газа:
2SO2 + O2 = 2SO3 + 197 кДж
III стадия производства– растворение оксида серы (Vl) в воде:
SO3 + H2O = H2SO4 + Q
Показ видеоролика «Производство серной
кислоты» (компакт-диск «Виртуальная школа
Кирилла и Мефодия» – «Уроки химии Кирилла и
Мефодия. 8-9 классы»).
Любые процессы переработки природного сырья
сопровождаются потерями вещества. Кроме того, не
все реакции протекают до конца. Поэтому сырье
используется не полностью. Эффективность его
использования определяется выходом продукта -
отношением массы полученного вещества к
теоретически достижимой массе (слад 13):
W% (выхода) =
• 100%
– Рассмотрим пример – задачу (слайд 14, учитель решает у доски, учащиеся записывают решение задачи).
Сырье – пирит содержит 80% полезного вещества FeS2. При обжиге 1 т пирита было получено 800 кг сернистого газа. Определить выход продукта.
Дано:
m(пирита) = 1 т
W (FeS2) = 0,8
mgракт. (SO2) = 800 кг____________________
W (выхода) – ?
Решение:
1. Определим массу FeS2
M(FeS2) = W(FeS2)*m(пирита)
M(FeS2) = 0,8 * 1000кг = 800кг
2. Вычислим теоретическую массу продукта
800кг x кг
4FeS2 + 11O2 = 8SO2 + 2Fe2O3 М(FeS2) = 120 г/моль
n 4моль 8моль М(SO2) = 64 г/моль
m 480г 512гх =
= 853кг
3. Определим выход продукта реакции
W (выхода) =
* 100%
W(выхода) =
* 100% = 94%
Ответ: выход продукта составляет 94%
III. Закрепление изученного материала
1. Стихотворение «Сера» (слайд 15):
Сера, сера, сера, эс.
Тридцать два – атомный вес.
Сера в воздухе сгорит,
Мы получим ангидрид.
Ангидрид её с водой
Станет серной кислотой.
Запишите уравнения химических реакций, о которых идёт речь в стихотворении.
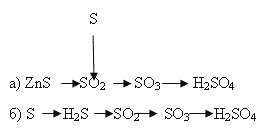
2. Напишите уравнения химических реакций, с помощью которых можно осуществить указанные превращения (слайд 16):
3. Задача: Каков объём (н.у.) слайд 17:
А) сернистого газа получится при обжиге на
воздухе 120 г пирита FeS2
Б) сероводорода получится при обработке 0,88 г
сульфида железа (ll) соляной кислотой.
IV. Рефлексия
Учащимся предлагается продолжить фразу “Уходя с урока, я хочу сказать…”. Также проводится оценивание работы учащихся на уроке.
V. Домашнее задание (слайд 18)
- & 19.1;
- задача № 15