Урок рассчитан на 90 минут для учащихся 10-11 классах обучающихся по программе Е.С.Габриеляна по учебникам базового уровня.
Тип урока: Комбинированный (сообщение новых знаний и их совершенствование).
Цель урока:
- Закрепить знания об аминокислотах , их реакциях и свойствах.
- Дать понятия о белках и пептидах на основе межпредметных связей с биологией. Рассмотреть строение, химические свойства и биологические функции белков.
- Представить практическую часть работы с белками в видеоверсии.
- В связи с валеологией дать характеристику белкам как важнейшим составным частям пищи (расширенный обзор о белках для учащихся 11 классов).
- Закрепление навыков работы компьютером .
Задачи урока:
Образовательные.
- Закрепить знания учащихся об аминокислотах, как органических амфотерных соединениях, их свойствах и реакциях.
- Актуализировать знания учащихся о белках как природных полимерах, построенных из остатков аминокислот, соединенных пептидной связью.
- Ознакомить учащихся с распространением белков в природе, их биологическими функциями и значением их для жизни на земле.
- Сформировать у учащихся знания о структурах белка, ее роли, а также физических и химических свойствах белковых молекул.
- Продолжить формирование практических умений и навыков при работе с химическими реактивами и оборудованием, показав в видеоверсии цветные реакции белков.
- Закрепить умения создавать и заполнять данными таблицу, использовать математические формулы в таблице, копировать формулы, организовывать защиту данных, применять автоформатирование, использовать логические функции, создавать ссылки.
Развивающие.
- Развивать память и внимание учащихся.
- Продолжить формирование химического научного языка.
- На основе межпредметных связей продолжить формирование умений устанавливать взаимосвязь между составом, строением и свойствами веществ.
- Знакомя учащихся с качественными реакциями на белки, способствовать развитию исследовательских навыков.
- Утвердить учащихся в познаваемости и единстве органического мира путем представления информации о классификации белков на основе разных признаков.
- Способствовать продолжению развития устойчивого интереса к химической науке и практике.
- Усоверщенствование познавательных интересов в области информатики и навыков работы на компьютере.
Воспитательные.
- Показать значимость химических знаний для современного наукоемкого производства и успешной адаптации будущих специалистов в современном обществе.
- Воспитывать бережное отношение к природе и здоровью человека.
- Реализовать экологическое воспитание, решая для себя задачи с экологическим содержанием.
- Продолжать воспитание информационной культуры учащихся и бережного отношения к результатам информационной деятельности человека;
План урока (слайд 2):
1.Организационный момент. Проверка домашнего задания. Контрольные вопросы (слайд 2)
2. Понятие о белках.
3. Структура белков.
4. Химические свойства белков. Качественные реакции на белки.
5. Белки как компонент пищи.
6. Закрепление материала: выполнение тестового задания по химии на персональном компьютере.
7. Домашнее задание.
Ход и содержание урока
Организационный момент.
На 2-м слайде представлен план урока и домашнее задание.
1. Проверка выполнения домашнего задания.
2. Контрольные вопросы (слайд 3):
- Какие соединения называются аминокислотами?
- Какие функциональные группы входят в состав аминокислот?
- Как строятся названия аминокислот?
- Какие аминокислоты называются незаменимыми? Приведите примеры.
- Какие соединения называются амфотерными? Обладают ли амфотерными свойствами аминокислоты? Ответ обоснуйте
- Какие химические свойства характерны для аминокислот?
- Какие реакции называются реакциями поликонденсации? Характерны ли реакции поликонденсации для аминокислот?
- Какие соединения называют пептидами?
- Какая группа атомов называется пептидной?
Ответы на контрольные вопросы актуализируют знания учащихся по теме "Аминокислоты". Важнейшим свойством аминокислот является реакция конденсации. На доске учащиеся записывают уравнение взаимодействия глицина с аланином
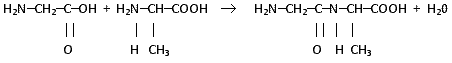
Группа атомов -CO-NH- , с помощью которой
связаны две ![]() -аминокислоты,
называется пептидной связью, а продукт реакции -
дипептидом. Дипептид, как и аминокислота,
обладает свободными аминогруппой и
карбоксильной группой. Следовательно, он
способен конденсироваться со следующей
молекулой аминокислоты. Учащиеся сами
формулируют определение полипептидов.
-аминокислоты,
называется пептидной связью, а продукт реакции -
дипептидом. Дипептид, как и аминокислота,
обладает свободными аминогруппой и
карбоксильной группой. Следовательно, он
способен конденсироваться со следующей
молекулой аминокислоты. Учащиеся сами
формулируют определение полипептидов.
Пептидами называют органические соединения,
содержащие два или более остатков ![]() -аминокислот, связанных
между собой пептидной связью.
-аминокислот, связанных
между собой пептидной связью.
По числу остатков аминокислот в молекуле различают дипептиды, трипептиды и так далее вплоть до полипептидов.
Пептидный фрагмент является плоским: углерод карбонильной группы, азот и связанные с ними четыре атома лежат в одной плоскости. Валентные углы при sp2-гибридном атоме углерода близки к 120°, при sp3 - гибридном атоме углерода - 110°.
Изображать молекулы пептида удобно с помощью буквенных обозначений аминокислот. Слева изображают остаток аминокислоты, сохранившей аминогруппу, а справа - аминокислоту с незамещенным карбоксилом. Например, формула дипептида, написанная на доске кем-то из учеников, будет выглядеть так: H2N-GLy-Ala-COOH.
В живых организмах синтез пептидов происходит из аминокислот при участии ферментов. Аминокислоты же поступают с пищей или синтезируются самим организмом.
Пептиды являются предшественниками боле сложных природных веществ-белков, однако сами по себе также играют важную роль в природе.
На экран выводятся соответствующие слайды 4-6 с основными понятиями и определениями.
Белками, или белковыми веществами называют высокомолекулярные (молекулярная масса варьирует от 5-10 тыс. до 1 млн. и более) природные полимеры, молекулы которых построены из остатков аминокислот, соединенных амидной (пептидной) связью.
"Жизнь есть способ существования белковых тел" - говорил Ф.Энгельс.
Белки, или протеин, в переводе с греческого "протос" - первый, главный, находятся в протоплазме и ядре всех растительных и животных клеток, являются главными носителями жизни: альбумин (в курином яйце), гемоглобин (в крови человека), казеин (в коровьем молоке), миоглобин и миозин (в мышцах).
Образование пептидной связи показано на слайде 7 с участием a -аминокислот - аланина, валина и глицина.
Подобно полипептидам, молекулы белков
представляют собой длинные цепи, состоящие из
остатков ![]() -аминокислот,
связанных между собой пептидными связями.
-аминокислот,
связанных между собой пептидными связями.
Белки - это высокомолекулярные соединения, молекулы которых представлены двадцатью a -аминокислотами, соединёнными пептидными связями - СО - NН. Мономерами белков являются аминокислоты. Химическое строение белков весьма просто: они состоят из длинных цепей остатков аминокислот, соединенных между собой пептидными связями (- СО - NН).
Белки отличаются друг от друга:
1) Последовательностью 20 аминокислот в длинных цепях, поэтому не удивительно, что каждый вид растений или животных обладает своими собственными белками, специфичными для данного вида.
2) Составом аминокислот
3) Количеством аминокислот
Кислотные свойства аминокислот определятся карбоксильной группой (- СООН), щелочные - аминогруппой (- NH2). Каждая из 20 аминокислот имеет одинаковую часть, включающую обе эти группы (- CHNH2 - COOH), и отличается от любой другой особой химической группировкой R - группой, или радикалом (слайд 8).
Существует несколько классификаций белков, в их основе лежат разные признаки (слайд 9).
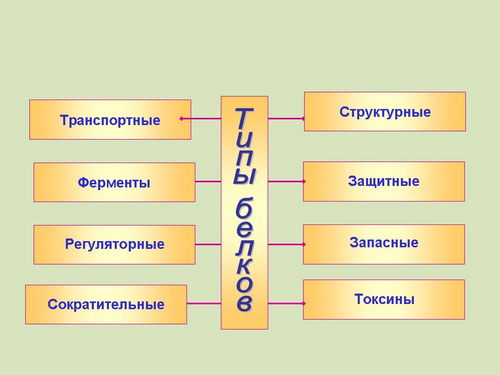
Функции белков: транспортная, ферментативная, регуляторная, сократительная, структурная, запасная, защитная (слайд 10 - 18).
Структуру белковых молекул можно рассматривать на нескольких уровнях (слойды 19 - 22).
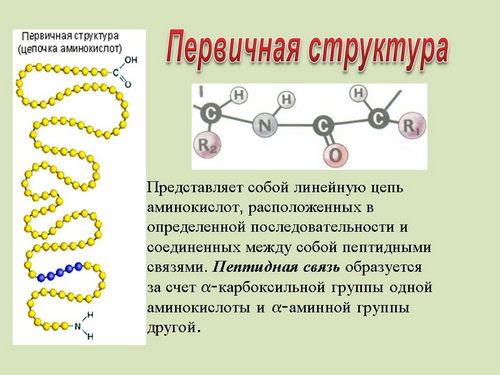
Первичная структура белка - это последовательность аминокислот в полипептидной цепи (на экране и индивидуальных компьютерах выведены структуры - слайды 7, 20, 21).
В полимерную молекулу входят остатки тех же
двадцати с небольшим природных ![]() -аминокислот, из которых
состоят полипептиды. Число аминокислотных
звеньев может колебаться от нескольких десятков
до сотен тысяч. Это отражается на молекулярной
массе белков, изменяющейся в широких пределах: от
6500 (инсулин) до 32 миллионов (белок вируса гриппа).
На основании определения молекулярной массы и
элементного состава белка можно установить
общую формулу белковой молекулы.
-аминокислот, из которых
состоят полипептиды. Число аминокислотных
звеньев может колебаться от нескольких десятков
до сотен тысяч. Это отражается на молекулярной
массе белков, изменяющейся в широких пределах: от
6500 (инсулин) до 32 миллионов (белок вируса гриппа).
На основании определения молекулярной массы и
элементного состава белка можно установить
общую формулу белковой молекулы.
Первичная структура белков играет чрезвычайно важную роль. Изменение только одной аминокислоты на другую может привести либо к гибели всего организма, либо к появлению совершенно нового вида. Замена одного остатка аминокислоты глутамина на валин в молекуле гемоглобина (содержащего 574 аминокислотные группы) вызывает тяжелейшее заболевание - анемию, приводящую к смертельному исходу.
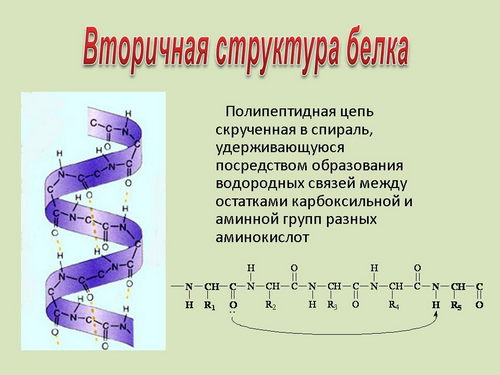
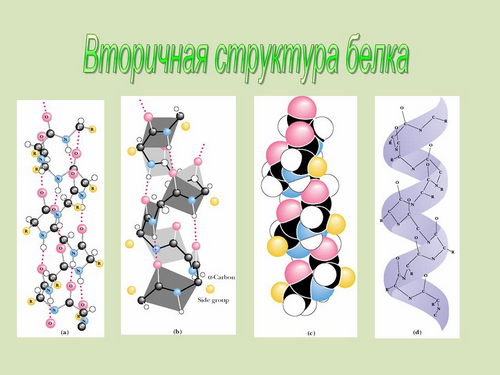
Вторичная структура белка. В
пространстве полипептидная цепь белка может
располагаться двумя способами. Она может быть
закручена в спираль, на каждом витке которой
располагается 3,6 звена аминокислот с обращенными
наружу радикалами. Отдельные витки скреплены
между собой водородными связями между группами
- NH и -CO различных участков цепи (на экране и
индивидуальных компьютерах выведены структуры
- слайды 22 - 25).Такая структура белка называется ![]() -спираль (слайды 22, 23) и
наблюдается, к примеру,
-спираль (слайды 22, 23) и
наблюдается, к примеру, ![]() -кератина (шерсть, волосы, рога,
когти).
-кератина (шерсть, волосы, рога,
когти).
Если боковые группы аминокислотных остатков не
очень велики (глицин, аланин, серин), две
полипептидных цепи могут быть расположены
параллельно и скрепляться между собой
водородными связями. При этом полоса получается
не плоской, а складчатой (на экране и
индивидуальных компьютерах выведены
соответствующие структуры). Это ![]() -структура белка, характерная , например,
для фиброина шелка.
-структура белка, характерная , например,
для фиброина шелка.
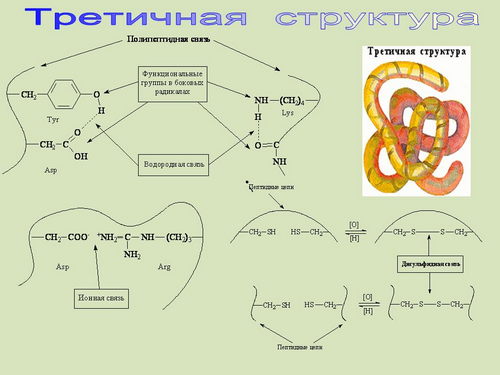
Третичная структура - это способ
расположения ![]() -спирали или ?-структуры в
пространстве. Белковая молекула свернутая в
клубок - глобулу, которая сохраняет
пространственную форму за счет
дисульфидных мостиков - S - S - . Эти мостики
образуются между двумя остатками цистеина
различных участков цепи (на экране и
индивидуальных компьютерах выведены
соответствующие структуры - сайды 26 - 28).
-спирали или ?-структуры в
пространстве. Белковая молекула свернутая в
клубок - глобулу, которая сохраняет
пространственную форму за счет
дисульфидных мостиков - S - S - . Эти мостики
образуются между двумя остатками цистеина
различных участков цепи (на экране и
индивидуальных компьютерах выведены
соответствующие структуры - сайды 26 - 28).
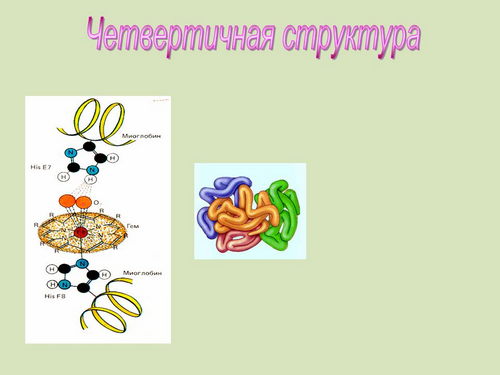
Четвертичная структура белка. Некоторые белки (например, гемоглобин) представляют собой сочетание нескольких белковых молекул с небелковыми фрагментами, называемыми простетическими группами. Такие6 белки именуются сложными или протеидами. Строение протеида и представляет собой четвертичную структуру белка (слайд 29). На слайдах 28, 29 представлено описание фибриллярных и глобулярных белков, а также соответствующие структуры.
При рассмотрении химических свойств белков учитель получает возможность украсить объяснение материала просмотром видеоматериала опытов, которые заранее были проведены и отсняты учителем с участием учащихся 11 классов.
Белки - амфотерные электролиты. При определении значения рН среды (она называется изоэлектрической точкой) число положительных и отрицательных зарядов в молекуле белка одинаково. Это одно из основных свойств белка. Белки в этой точке электронейтральны, а их растворимость в воде наименьшая.
Основные свойства белков
1. Гидратация. Процесс гидратации означает связывание белками воды, при этом они проявляют гидрофильные свойства: набухают, их масса и объем увеличиваются. Набухание белка сопровождается его частичным растворением. Гидрофильность отдельных белков зависит от их строения. Имеющиеся в составе и расположенные на поверхности белковой макромолекулы гидрофильные амидные (-CO - NH -, пептидная связь), аминные( -NH2) карбоксильные (-COOH) группы притягивают к себе молекулы воды, строго ориентируя их на поверхности молекулы. Окружающие белковые глобулы гидратная оболочка препятствует агрегации и осаждению, а следовательно, способствует устойчивости растворов белка.
2. Денатурация (слайды 30 - 32, приложение 1,2,3). Под влиянием внешних факторов (температуры, механического воздействия, действия химических агентов и ряда других факторов) происходит изменение вторичной, третичной и четвертичной структур белковой макромолекулы. Первичная структура, а следовательно, и химический состав белка не меняются. Изменяются физические свойства: снижается растворимость, способность к гидратации, теряется биологическая активность. Меняется форма белковой молекулы, происходит агрегирование.
3. Пенообразование. Под процессом пенообразования понимают способность белков образовывать высококонцентрированные системы "жидкость - газ", называемые пенами. Устойчивость пены, в которой белок является пенообразователем, зависит не только от его природы и его концентрации, но и от температуры.
4. Гидролиз белков. Под действием ферментов, а также водных растворов кислот и щелочей происходит разрушение первичной структуры белка в результате разрыва пептидных связей. Гидролиз - основа процесса пищеварения.
5. Горение. Белки горят с образованием азота, углекислого газа и воды, а также некоторых других веществ. Горение сопровождается характерным запахом жженых перьев.
6. Цветные реакции белков (слайды 33 - 35). (Качественные реакции на белки).
- ксантопротеиновая. Происходит взаимодействие ароматических и гетероатомных циклов в молекуле белка с концентрированной азотной кислотой, сопровождающееся появлением желтой окраски.
- биуретовая. Происходит взаимодействие слабощелочных растворов белков с раствором сульфата меди (II) с образованием комплексных соединений между ионами меди и полипептидами. Реакция сопровождается появлением фиолетово-синей окраски.
Роль белков для человека.
Белки, распадаясь в организме, являются, так же как углеводы и жиры, источником энергии. Энергия, получаемая при распаде белков, может быть без всякого ущерба для организма компенсирована энергией распада жиров и углеводов. Однако очень важно, что организм человека и животных не может обходиться без регулярного поступления белков извне.
Опыт показывает, что даже довольно длительное выключение жиров или углеводов из питания животного не вызывает тяжелых расстройств здоровья. Но прием в течение нескольких дней пищи, не содержащей белков, приводит к серьезным нарушениям, а продолжительное безбелковое питание неизбежно кончается смертью животного. Все это имеет место даже при обильном питании углеводами и жирами.
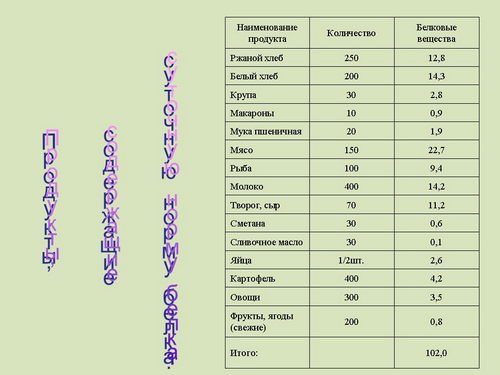
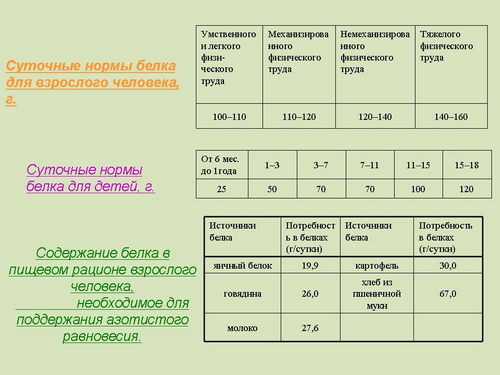
Какое же количество белка необходимо в питании человека, чтобы обеспечить сохранение его здоровья и работоспособности (слайд 36)? "Коэффициент изнашивания" у взрослого человека составляет около 23 граммов белка. Но азотистое равновесие устанавливается при приеме более высоких количеств белка в пище, чем того требует так называемый "коэффициент изнашивания". В среднем азотистое равновесие устанавливается у человека при потреблении 30-45 граммов белка в сутки. Этот минимум белка, необходимый для того, чтобы поддерживать азотистое равновесие на рационе, полностью покрывающем энергетические потребности организма, получил название "физиологического минимума белка". Азотистое равновесие у человека и животных, таким образом, возможно, получить при приеме с пищей белка в количестве примерно вдвое большем, чем это необходимо по "коэффициенту изнашивания".
Ученые пришли к выводу (слайд 37), что взрослый человек должен потреблять ежедневно при трате энергии в 1500 ккал не менее 100 грамм, а в жарком климате - не менее 120 грамм белка. Эти нормы соответствуют умственному труду или труду физическому, полностью механизированному. При расходовании большего количества энергии, то есть при физическом труде, недостаточно механизированном, необходимо употребление большего количества белков.
Задания для закрепления материала: выполнение учащимися теста за персональным компьютером (приложение 4)
На слайде 38 домашнее задание.