Вступительное слово преподавателя: Мы начали изучать важнейшие классы неорганических соединений. С каким классом неорганических соединений мы познакомились на прошлом уроке?
Предполагаемый ответ: Оксиды.
Слово преподавателя: Выполнение следующих заданий позволит проверить знания по этой теме.
(Опрос проводится в индивидуальной форме и по парам. Задания для проверки знаний дается в электронном виде, программа Notebооk).
Задание №1 для студента
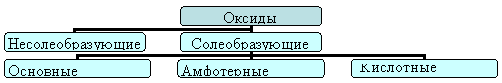
Из предложенных заготовок понятий составьте на доске опорную схему по теме: "Классификация оксидов". Сделайте краткий обобщающий рассказ по схеме.
На доске дана заготовка схемы и понятия: солеобразующие, основные, несолеобразующие, амфотерные, кислотные.
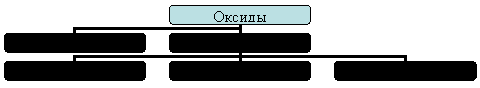
Предполагаемый ответ:
Затем всем студентам предлагается выполнить задание по парам.
Задание №2 На доске представлены формулы оксидов: СаО, СО, Аl2О3, Р2О5, Сr2О3, СО2, Nа2О
Студенты должны распределить формулы оксидов по соответствующим группам: несолеобразующие, основные, кислотные и амфотерные.
Задание выполняется на одном листке, сдается на проверку преподавателю.
Предполагаемый ответ:
Несолеобразующие - СО. Основные - СаО, Nа2О. Амфотерные - Аl2О3 , Сr2О3. Кислотные - Р2О5, СО2.
Пока преподаватель проверяет задание №2, студенты приступают к выполнению задания №3.
Задание №3 На доске написаны формулы для двух вариантов.
Вариант №1
СО2 , N2О, Сr2О3, СrО3, СаО
Вариант №2
V2O5, Cl2O7, ZnO, FeO, СО
Студенты должны дать название оксидам по формуле.
Предполагаемый ответ:
Вариант №1
СО2 - оксид углерода (IV), N2О - оксид азота (I), Сr2О3 - оксид хрома (III), СrО3- оксид хрома (VI), СаО - оксид кальция.
Вариант №2
V2O5 - оксид ванадия (V), Cl2O7 оксид хлора (VII), ZnO - оксид цинка, FeO - оксид железа (II), СО - оксид углерода (II).
Преподаватель предлагает студентам проверить, как они выполнили задание №3. От каждого варианта приглашается по одному студенту, чтобы записать на интерактивной доске названия оксидов. Преподаватель корректирует, если это необходимо, записи на доске, а студенты исправляют в тетрадях. Преподаватель проговаривает критерии оценки задания №3, а студенты выставляют себе оценку. Преподаватель сообщает оценки за задание №2.
Изучение нового материала
Слово преподавателя: вы уже многое узнали о веществах, об их практическом использовании. Сегодня вам предстоит ещё раз убедиться в том, что химия многолика.
В детстве вы, наверное, читали эти стихи:
Да здравствует мыло душистое,
И полотенце пушистое,
И зубной порошок,
И густой гребешок!
Давайте же мыться, плескаться,
Купаться, нырять, кувыркаться:
Я не случайно вспомнила стихи этого поэта. Кстати, кто их автор? (Корней Чуковский) Дело в том, что люди давно заметили необходимость ухода за кожей, поддержания её в чистоте. Солдаты перед боем обычно мылись, надевали чистое бельё. Этот обычай не случаен: на чистой коже раны заживают быстрее.
Вам будет интересно узнать, что на одном квадратном сантиметре кожи здорового человека находится от 100 тыс. до 3 млн. микроорганизмов. При загрязнении кожи резко снижается её способность к выделению защитных веществ, убивающих возбудителей болезней.
Кожа детей нежнее, чем кожа взрослых, поэтому она более ранима. Проникающие через трещины или царапины микроорганизмы иногда вызывают нарывы, воспаления, а при загрязнении ран землёй в организм могут проникнуть возбудители столбняка - одного из тяжелейших заболеваний.5 Вот почему так важна забота о чистоте кожи для того, чтобы кожа была чистой, необходимо использовать моющие средства, например, мыло.
А знаете ли вы, почему мыло моет? Ответить на этот вопрос позволит знакомство с веществами нового класса, который Вы сегодня изучите в первой половине урока.
Предлагаю вам опытным путём определить состав выданного моющего средства.
Вы будете выполнять лабораторную работу в микрогруппах (по 4 человека). На нее отводится 5 минут. Инструкция для выполнения лабораторной работы находится на ваших столах. В инструкции указан номер группы и прописано задание.
- Первая группа исследует твёрдое мыло.
- Вторая группа - синтетическое моющее средство.
Лабораторный опыт №1 "Состав моющих средств"
1. Приготовьте раствор выданного Вам моющего средства. Для этого в пробирку с моющим средством прилейте дистиллированной воды объемом не более половины содержимого пробирки.
2. С помощью различных индикаторов (фенолфталеина, универсальной лакмусовой бумажки) исследуйте реакцию среды в растворе.
Для исследования реакции среды с помощью лакмусовой бумажки смочите стеклянную палочку в растворе моющего средства, а затем палочкой дотроньтесь до лакмусовой бумажки.
Как изменилась окраска индикатора?
Для исследования реакции среды с помощью фенолфталеина: прилейте в пробирку 2-3 капли индикатора. Как изменилась окраска индикатора?
3. Сделайте вывод о составе моющего средства. Для этого по таблице "Окраска индикаторов в различных средах" по окраске вашего раствора определите его среду.
Таблица - Окраска индикаторов в различных средах
| Индикаторы Среда |
Лакмус | Фенолфталеин | Метиловый оранжевый |
| Кислая | Красный | Бесцветный | Розовый |
| Щелочная | Синий | Малиновый | Жёлтый |
| Нейтральная | Фиолетовый | Бесцветный | Оранжевый |
(Студенты должны определить, что среда раствора щелочная).
4. Результаты вашей работы запишите в тетради в форме таблицы "Состав моющих средств".
(Незаполненная таблица появляется на доске)
Таблица - Состав моющих средств
| Моющее средство | Окраска фенолфталеина | Окраска лакмуса | Среда раствора |
После того, как студенты провели лабораторную работу и сказали полученный результат, на доске высвечивается таблица "Состав моющих средств" с ответами. Студенты должны сделать вывод, какое вещество входит в состав моющих средств. Вывод записывается в тетрадь.
Предполагаемый ответ:
Таблица - Состав моющих средств
| Моющее средство | Окраска фенолфталеина | Окраска лакмуса | Среда раствора |
| Твёрдое мыло | Малиновая | Синяя | Щелочная |
| СМС | Малиновая | Синяя | Щелочная |
Слово преподавателя: Щёлочь - это растворимое основание.
Таким образом, мы подошли с вами к новому классу неорганических соединений: ОСНОВАНИЯ
(Заставка: На экране доски появляется название и цель урока)
В тетрадях делаем заголовок: Важнейшие классы неорганических соединений. Ниже записываем подзаголовок: Основания.
Наша цель занятия - выяснить, какие соединения можно отнести к основаниям. Вам предлагается просмотреть фрагмент видеофильма "Основные классы неорганических соединений: Основания" и ответить на вопросы, представленные на доске:
1. Какова общая формула оснований?
2. Дайте определение понятия "Основания".
3. Чему равно количество гидроксильных групп ОН в основаниях?
(Просмотр студентами видеофрагмента)
Студенты отвечают на вопросы. Ответы затем появляются на доске, и студенты записывают их в тетрадь.
Вопрос 1. Какова общая формула оснований?
Предполагаемый ответ: М(ОН) n - общая формула оснований.
Вопрос 2. Дайте определение понятия "Основания".
Предполагаемый ответ: Основания - это сложные вещества, состоящие из атомов металла и гидроксильных групп (ОН).
Вопрос 3. Чему равно количество гидроксильных групп ОН в основаниях?
Предполагаемый ответ: Количество групп ОН совпадает с валентностью металла
Теперь мы с вами обладаем достаточными знаниями, чтобы суметь ответить на вопрос, поставленный в начале урока: почему мыло моет?
Предполагаемый ответ: при контакте мыла с водой образуется щёлочь, а все щелочи мылкие на ощупь.
Слово преподавателя: Исследуйте, обладает ли нерастворимое основание такими же свойствами, как щелочь. Проведите второй опыт, работая в микрогруппах по 4 человека по инструкции, которая у вас на столе. На его выполнение дается 3-4 минуты.
Лабораторный опыт №2 "Свойства нерастворимых оснований"
1. Перед Вами в пробирке находится взвесь Сu(OH)2 гидроксида меди (II) в воде.
2. Определите реакцию среды в воде над гидроксидом меди (II):
смочите стеклянную палочку в пробирке с гидроксидом меди (II), а затем дотроньтесь до лакмусовой бумажки; капните в пробирку с гидроксидом меди (II) 2-3 капли фенолфталеина.
3. Сделайте вывод, какими свойствами обладает нерастворимое основание.
На основании проведенных лабораторных опытов №1, 2 осуществите структурирование материала, внеся данные в схему, отражающую классификацию оснований (Схема на доске).
Схема "Классификация оснований"
Основания
I. По растворимости в воде
| 1.Растворимые (щёлочи) Студенты должны вписать: изменяют окраску индикатора; мылкие на ощупь. |
2. Нерастворимые не изменяют окраску индикатора. |
Слово преподавателя: И ещё на один вопрос необходимо нам ответить: По какому ещё признаку можно классифицировать основания, и на какие группы разделить по этому признаку? Ответ вы найдёте в тексте, предложенном вам (Приложение 1).
(Студенты читают раздаточный материал и находят в нем ответы)
Предполагаемый ответ: Второй признак, по которому классифицируют основания - число гидроксогрупп, то есть по кислотности подразделяют на:
1. Однокислотные.
2. Двухкислотные.
3. Трехкислотные.
Для закрепления рассмотренного материала всем студентам предлагается выполнить задание.
На экране доски представлены формулы оснований: Ca(OH)2, NaOH, Fe(OH)3, Cr(OH)2, Аl(OH)3 , Cu(OH)2, LiOH, Fe(OH)2.
Студенты должны распределить формулы оснований по соответствующим группам: по кислотности; по растворимости в воде. Задание выполняется на листочках, сдается на проверку преподавателю. На выполнение задания отводится 5 минут. Можно предложить несколько формул из этого списка.
Предполагаемый ответ:
| Вариант №1 | Вариант №2 |
| Однокислотные - NaOH. Двухкислотные- Ca(OH)2,Cr(OH)2. Трехкислотные - Fe(OH)3. Растворимые - NaOH, Ca(OH)2. Нерастворимые - Cr(OH)2, Fe(OH)3. |
Однокислотные - LiOH. Двухкислотные - Cu(OH)2, Fe(OH)2 Трехкислотные - Аl(OH)3. Растворимые - LiOH. Нерастворимые - Аl(OH)3 , Cu(OH)2, Fe(OH)2. |
Студентам предлагается следующее задание.
Слово преподавателя: Обратите внимание на экран: перед вами слайд "Построение названий оснований - номенклатура". Внимательно прочтите его.
Попробуйте назвать основания по представленной номенклатуре. (К доске выходит по желанию студент и рядом с формулой пишет название. Преподаватель открывает на доске правильные ответы.)
Предполагаемый ответ: Ca(OH)2 - гидроксид кальция; NaOH - гидроксид натрия, Fe(OH)3 - гидроксид железа (III), Cr(OH)2 - гидроксид хрома (II), Аl(OH)3 - гидроксид алюминия, Cu(OH)2 - гидроксид меди (II), LiOH- гидроксид лития, Fe(OH)2 - гидроксид железа (II).
Слово преподавателя: Завершает нашу первую часть урока сообщение на тему: "История мыла". (Один из студентов подготовил презентацию.)
Слово преподавателя: Перед тем как приступить ко второй части урока, предлагаю вам сделать умную разминку.
(Студенты встают, преподаватель читает стихи, представленные на экране доски, и показывает движения, остальные повторяют)
Умная разминка:
Правил безопасности много есть у нас.
Мы расскажем главные - помни их всегда!
Опыт можно проводить только с разрешения,
Так как могут не простить наши прегрешенья.
Чтоб разбавить кислоту лил в неё водицу?
Плохо! Видно за версту - это не годится!
Химик же, наоборот, вот как поступает:
Кислоты чуть-чуть прильёт в воду и мешает.
К носу совершай рукой легкие движенья.
Вот тогда нюхач такой - просто загляденье!
Навсегда запомните: правила важны.
Зная их, вы с химией будете дружны!
(Следующая часть урока проходит как путешествие по стране кислот. На экране доски карта путешествия).
Слово преподавателя: Представьте себе, что это - не класс. Отправимся все мы на 40 минут в страну, где нас кислоты ждут.
Знанья свои мы в дорогу возьмём. По станциям мы их с собой провезём. А чтобы домой нас привёз паровоз, на каждой станции ждёт нас - опрос.
Итогом урока будет ответ: "Не узнавших о кислотах в классе нет!" 3
На нашем пути мы встретим следующие станции: 1. Историческая. 2. Дегустационная. 3.Информационная. 4. Правила техники безопасности. 5. Индикаторная.
На каждой станции есть свои дежурные, они поделятся с нами интересной информацией, в конце пути дежурные подготовили для нас вопросы.
Итак, все готовы к путешествию. Тогда вперёд!
1. Станция "Историческая"
Прослушав дежурного, вы должны будете сделать записи в своих тетрадях о первых кислотах, с которыми человек познакомился впервые.
(Дежурный по станции рассказывает историю открытия важнейших кислот. Рассказ сопровождается презентацией)
2. Станция "Дегустационная"
Прослушав дежурного, Вы должны будете сделать записи в своих тетрадях о вкусе кислот.
(Дежурный по станции рассказывает о растениях, содержащих кислоты. Рассказ сопровождается презентацией)
Автор презентации обращает внимание, что в химическом кабинете ничего нельзя пробовать на вкус, это грубейшее нарушение правил ТБ, и обращается к аудитории: Сегодня мы сделаем исключение из правил. Перед вами на салфетке лежит таблетка аскорбиновой кислоты, её можно попробовать.
Что вы можете сказать о вкусе аскорбиновой кислоты?
Предполагаемый ответ: Кислота кислая на вкус.
3. Станция "Информационная"
(Дежурный по станции знакомит с общей формулой кислот, определением, классификацией, дает примеры кислот. На экране доски высвечивается необходимая информация (Приложение 7)).
Дежурный студент обращает внимание, что кислоты - очень активные вещества, проводить с ними опыты нужно очень аккуратно.
При работе с кислотами нужно обязательно знать правила техники безопасности.
4. Станция "Правила техники безопасности"
(Дежурный по станции знакомит с инструкцией по ТБ при работе с кислотами, предлагает посмотреть фрагмент видеофильма, иллюстрирующий взаимодействие серной кислоты с водой)
Студент обращает внимание на правила работы с концентрированной серной кислотой, представленной в инструкции на экране. Такая же инструкция находится на столах остальных студентов.
(Студенты внимательно изучают инструкцию (Приложение4))
5. Станция "Индикаторная"
(Дежурный по станции знакомит с историей открытия индикаторов. Рассказ сопровождается презентацией и демонстрацией опыта изменения окраски индикаторов в 2 %-ном растворе уксусной кислоты. Студенты фиксируют увиденное в таблице, представленной на экране)
| Кислота | Фенолфталеин | Метиловый оранжевый | Лакмусовая бумажка |
| Уксусная | Б/ц | ярко-красный | кислота |
Слово преподавателя: Итак, наше путешествие по стране кислот подходит к концу, и нам нужно возвращаться. Для этого мы пройдем по маршруту обратно, вспомним и закрепим всё, что узнали о кислотах.
(Проводится фронтальный опрос по кислотам (Приложение5). Во время опроса на экране доски высвечиваются подсказки, если студент затрудняется с ответом)
Рефлексия
Слово преподавателя: В заключение ответьте на вопросы:
Понравился ли вам урок? Какое настроение? Чему вы сегодня на уроке научились?
Если студенты затрудняются ответить на последний из вопросов, то преподаватель обращает внимание студентов, что они научились: проводить исследования, заполнять таблицы, анализировать, сравнивать, делать выводы, составлять схему, отвечать на вопросы, находить главное, работать в парах и самостоятельно.
Домашнее задание
- Задание №1: Студентам предлагается найти на сайте техникума, электронный адрес которого: dht.my1.ru, таблицу, включающую в себя 16 кислот, и переписать её в тетрадь.
- Задание №2: Студентам предлагается составить кроссворд по теме: "Основания. Кислоты", включающий в себя не менее 10.