
Цели:
- закрепить и обобщить знания о свойствах основных классах неорганических соединений,
- закрепить понятия о генетическом ряде элементов,
- развить умение осуществлять переходы от одного соединений к другим с помощью метода коллективного обучения.
Задачи: На данном этапе обучения ученики должны:
- классифицировать неорганические вещества по составу и свойствам;
- составлять генетические ряды металлов и неметаллов;
- иллюстрировать уравнения химических реакций, генетическую связь между членами ряда;
- охарактеризовать химические вещества данного класса ;
- знать основные связи между классами неорганических соединений;
- уметь доказать основной и кислотный характер свойств неорганических соединений.
Форма организации работы: Групповая, фронтальная и индивидуальная.
Оборудование: Химические тренажеры, проектор.
План урока:
1. Обобщение знаний о классификации веществ
(самостоятельная работа с химическими тренажерами).
2. Самостоятельная работа учащихся по составлению генетического ряда углерода.
3. Выступления учащихся о круговороте углерода в природе и влияние этих веществ на экологию.
4. Определение термина "Генетическая связь".
5. Закрепление (игра в "крестики и нолики", работа в парах).
6. Составление генетической связи между классами неорганических соединений.
7. Подведение итогов.
8. Обсуждение домашнего задания
Ход урока
Учитель: У нас сегодня обобщающий урок и вначале давайте вспомним, как можно разделить вещества на группы.
Учащимся выдаются химические тренажеры
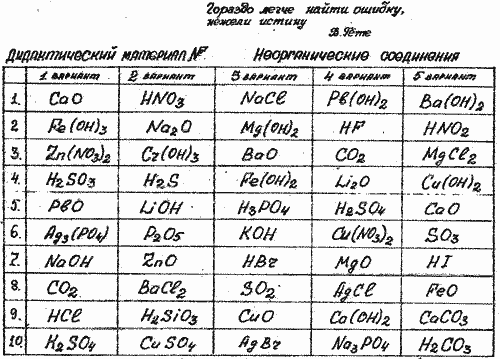
Задания для фронтальных тренировочных диалогов:
1. Выберите в вашем варианте формулы оксидов, объясните свой выбор, опираясь на знание признаков состава данного класса соединений
2. В столбце формул вашего варианта найдите формулы кислот и объясните свой выбор на основании анализа состава этих соединений.
3. Определите валентности кислотных остатков в составе кислот.
4. Выберите и назовите формулы солей.
5. Составьте формулы солей, которые могут быть образованы магнием и кислотами вашего варианта. Запишите их, назовите. (задание выполняется письменно в процессе самостоятельной работы).
6. Назовите все вещества, формулы которых даны в вашем варианте
7. В столбце формул вашего варианта найдите формулы оснований и объясните свой выбор на основании анализа состава этих соединений.
8. В вашем варианте выберите формулы веществ, с которыми может реагировать раствор ортофосфорной кислоты (соляной, серной).Составьте соответствующие уравнения реакций (задание выполняется письменно в процессе самостоятельной работы).
9. Среди формул своего варианта выберите формулы веществ, способных взаимодействовать между собой. Составьте соответствующие уравнения реакций (задание выполняется письменно в процессе самостоятельной работы).
10. Составьте цепочку генетических связей неорганических соединений, в состав которой войдет вещество, формула которого дана в вашем варианте под номером один.
При работе с мини-тренажерами учитель в основном направляет деятельность учащихся. Последние проговаривают ответ про себя или отвечают вслух, имея при этом возможность осуществить самоконтроль, сравнивая свой вариант ответа с тем, что говорит вызванный учителем товарищ. Это способствует овладению химическим языком и является важным ключом к полноценному освоению базовых знаний по химии при экономии времени, которая достигается за счет единообразия комплекта дидактических материалов и примерно одинаковой организации работы с ними. Единообразие не ведет к однообразию, поскольку содержание деятельности, организуемой учителем, может быть очень различным , концентрируется внимание учащихся, но не утомляет их, так как на это затрачивается немного времени 3-10 минут.
Работа ведется в быстром темпе, она может носить игровой характер. Включая элементы соревнования. Таким образом, мини- тренажер обеспечивает активное участие в познавательной деятельности практически всех учеников, находящихся в классе.
После работы с мини-тренажерами учащимся дается задание.
(слайд 2)
Ответ на поставленный вопрос:
С -> СО2 -> Н2СО3 -> СаСО3
Рассмотрев родственный генетический ряд углерода, давайте проанализируем влияние этих веществ на экологию Земли и круговорот углерода в природе.
Выступление учащихся (трое учащихся заранее готовят сообщение):
Существует тесная связь между загрязнениями атмосферы и климатическими факторами, которые во многом определяются тепловым балансом планеты. Нарушение такого баланса может привести к диаметрально противоположным экологическим катастрофам - к всемирному оледенению или резкому потеплению.
Средняя температура воздуха вблизи земной поверхности составляет 140С. Расчеты показывают, что если бы из атмосферы исчез углекислый газ, то температура была бы минус 200С. Диоксид углерода создает так называемый парниковый эффект.
Речь идет о том, что слой СО2 играет ту же роль, что и стекло парника: поглощая излученное Землей тепло, он повышает температуру нижней части тропосферы.
Ежегодно выбросы углекислого газа в атмосферу увеличиваются, но его концентрация растет значительно медленнее, чем это следует из расчетов по количеству сжигаемого топлива.
Большое значение в этом имеет океан, в котором содержание СО2 по массе в несколько десятков раз больше чем в атмосфере.
Углекислота, образующаяся при растворении СО2 в воде, связывается с ионами кальция в растворимый известняк СаСО3:
СО2+ Н2О <-> Н2СО3
Са2+ + Н2SО4 ->СаСО3+2Н+
Количество известняка, образовавшееся за всю историю Земли, в десять тысяч раз больше современного содержания СО2 в атмосфере. Кроме того, углекислота потребляется фотосинтезирующими организмами океана и через трофические цепи переходит в биомассу других организмов океана. Отмершие организмы оседают на дно океана, со временем превращаясь в ископаемый уголь и нефть. Количество СО2, погребенного с этими ископаемыми, примерно в 1000 раз больше современного его содержания в атмосфере. Углекислый газ выводится из атмосферы так же и фотосинтезирующими наземными организмами. Интенсивность этого биологического потока характеризируется следующим образом: за 300 - 400 лет организмы потребляют такое количество СО2, которое равно его содержанию в атмосфере.
Вывод углекислого газа из атмосферы можно проиллюстрировать схемой:
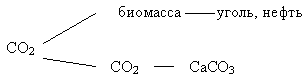
Скорость массаобмена между атмосферой и поверхностным слоем океана достаточно велика. За год в океане могут раствориться десятки миллиардов тонн атмосферного СО2, что превышает его количество, образующееся при сжигании всех видов топлива.
Известно, что концентрация диоксида углерода в атмосфере в разные периоды истории нашей планеты подвергались резким колебаниям. Вполне вероятно, что именно содержание СО2 в атмосфере определяло температурный уровень Земли. В истории Земли наблюдались периоды с тропическим климатом и периоды оледенения, которые следовали друг за другом с интервалом примерно 250 млн. лет.
Важнейшую роль в круговороте элементов играют растения и животные. В последнее столетие особенно заметно влияние деятельности человека на природные циклы.
В атмосфере углерод содержится в виде газообразующего диоксида углерода.
В океане и пресных водах Земли углерод находится в двух главных формах - в составе взаимосвязанных неорганических частиц: гидрокарбонат - иона НСО3=, карбонат - иона СО32- и растворенного диоксида углерода.
Огромное количество углерода сосредоточено в виде органических соединений в тканях животных, и растений, в почве и минералах - карбонатах (известняк, доломит, мел, мрамор). Часть углерода входит в состав нефти, каменного угля и природного газа.
Связующим звеном в природном круговороте углерода является диоксид углерода.
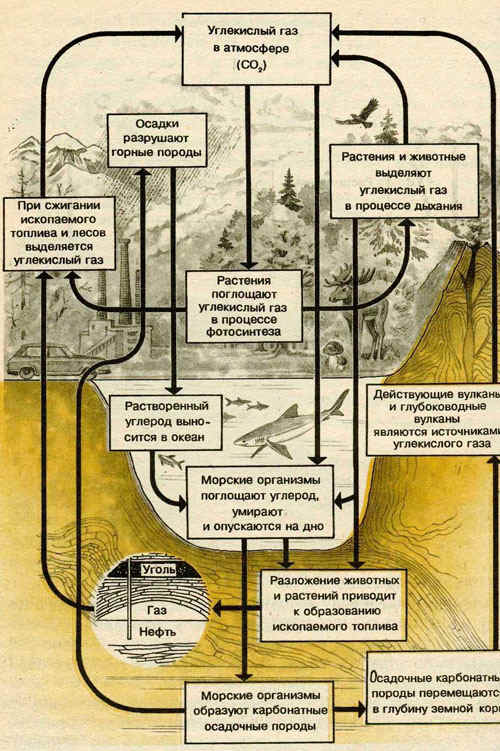
В последнее столетие в углеродный цикл существенные изменения внесла хозяйственная деятельность человека. Она привела к увеличению поступления диоксида углерода в атмосферу. Это поступление не очень сильно влияет на распределение масс углерода между оболочками Земли, но может иметь серьёзные последствия из-за усиления парникового эффекта.
Учитель: Между простыми и сложными веществами (оксидами, кислотами, основаниями, солями) существует взаимная (генетическая ) связь, а именно возможность их взаимного превращения - из простых веществ можно получить оксиды, последние превратить в основания, кислоты в соли. В свою очередь от солей можно при определенных условиях осуществить обратный переход к основаниям, кислотам, оксидам, простым веществам.
Запись в тетради: Связь между классами соединений, основанная на получении веществ, другого класса, называется генетической.
Закрепление
Для того чтобы закрепить изученный материал, учащимся можно предложить нетрадиционный подход к изучению предмета. Эти задания можно отнести к "минуткам отдыха": Игра в "крестики и нолики".
(слайд 3)
Учитель: Но генетическая связь существует не только между веществами одного генетического ряда, но и между генетическими рядами. Ее устраивают при получении веществ одного класса из веществ другого класса при взаимодействии их друг с другом. И теперь, когда мы вспомнили основные классы неорганических соединений делимся на два варианта по горизонтали (первый ряд парт- первый вариант, второй ряд-второй вариант и далее повторение вариантов) и работаем в парах.
На доске проектируется набор веществ, для двух вариантов:
(слайд 4)
Один из вариантов задания:
- I вариант: Zn -Ю> ZnSO4 -> Zn(OH)2 -> ZnO Zn
- II вариант: Са -> H2 -> Н2О -> KOH -> КCl
Во время работы класса два ученика у доски (на обратной стороне "крыльев")
Выполняют работу I и II вариантов под контролем.
Подводим итог изученного на уроке материала:
1. Металлы и неметаллы образуют генетические ряды.
2. Между простыми и сложными веществами, представителями разных классов, существует родственная связь, называемая генетической, которая проявляется в получении одних веществ из других.
3. Знание генетической связи, позволяет получать новые вещества определенного состава.
(слайд 5)
(слайд 6 )
Домашнее задание: составьте схему постепенного перехода от кальция к карбонату кальция и сообщение о медико-биологическом значении кальция и его соединений, используя дополнительную литературу.
Один из вариантов выполнения домашнего задания:
(Cа -Ю СаО -Ю Са(ОН)2 ->СаСО3)
Для нормального протекания физиологических процессов в организме должна поддерживаться определенная степень насыщения тканей химическими элементами. Под нормальным насыщением тканей организма химическими элементами следует понимать такое состояние, при котором тот или иной химический элемент находится в тканях в количестве, полностью удовлетворяющем потребности в этом элементе биохимических структур и необходимом для динамики биохимических циклов.
В организме химические элементы находятся либо в белково-связанном виде, либо в ионном состоянии, т.е. в виде неорганических соединений.
Состояние химических элементов в организме, а также характер химических связей зависят от особенностей органов и тканей, в которых находится данный химический элемент.
Кальций содержится в каждой клетке тела человека. В организм кальций поступает в основном с пищевыми продуктами (молоко, овощи, злаки). Концентрация ионов кальция в организме регулируется гормонами паращитовидных желез. Всасывание кальция зависит от многих причин. Основным регулятором усвоения кальция является, в частности витамин D. При недостатке этого витамина, всасывание кальция уменьшается. Кальций является главным компонентом костной ткани и зубов, куда он входит в виде солей СаСО3 и Са3(РО4)2 . Содержание кальция в костях находится в тесной зависимости от наличия солей Н3РО4. От количественного содержания кальция в скелете зависит его твердость, рост и минерализация кости.
Ионы Са2+ принимают участие в передаче нервных импульсов, сокращении мышц, регулировании работы сердца, свертывании крови. Поскольку кальций снижает возбудимость клеток ЦНС, его уменьшение в организме сопровождается возбуждением НС. Ионы кальция влияют на кислотно- основное равновесие, функцию эндокринных желез, оказывают противовоспалительное и дестабилизирующее действие.
Хлорид кальция уменьшает проницаемость сосудов, оказывает противовоспалительное действие. Его применяют при аллергических заболеваниях, лучевой болезни, ревматизме, кровотечениях, переломах костей, кожных заболеваниях, а также при отравлениях солями магния, щавелевой кислотой, солями фтористоводородной кислоты, свинцом, ртутью, фосгеном.
Сульфат кальция (жженый гипс) 2СаSО4 *Н2О применяется для гипсовых повязок, при переломах и в зубоврачебной практике, чтобы получить слепки полости рта.
Растворимые в воде соединения кальция применяются в медицине для электрофореза.
В конце урока учитель выставляет оценки.