Цели урока:
- Углубить и обобщить знания учащихся о состоянии химического равновесия, условиях его смещения.
- Дать понятие о константе равновесия.
Задачи урока:
- Закрепить знания о способах смещения равновесия.
- Развить навыки в решении расчетных задач с использованием понятия константа равновесия.
- Показать важность изучения химического равновесия и его практическое значение в химической промышленности.
- Продолжить формирование таких логических приемов, как наблюдение, анализ, сравнение, обобщение
- Совершенствовать экспериментальные умения и навыки.
Оборудование и реактивы: Пробирки, химические стаканы, горячая вода, снег, раствор крахмала, йод, роданид калия, хлорид железа (III), хлорид калия (кристалл.). Мультимедийный проектор, компьютер.
Ход урока
Учитель вместе с учащимися определяет тему, цель и задачи урока. (Мультимедийная презентация. Приложение 1, демонстрация 1-2 слайдов).
I. Ориентировочно-мотивационный этап
Вопросы к учащимся:
-
Что такое химическая реакция?
-
Признаки химических реакций?
-
Классификация химических реакций?
-
Какие реакции называют: а) необратимыми, б) обратимыми? Приведите примеры.
-
Какие из приведенных химических реакций являются обратимыми и почему? (демонстрация слайда)
NaOH + HCl —> NaCl + H2O
N2 + 3H2 —> 2NH3
AgNO3 + NaCl —> AgCl + NaNO3
SO3 + H2O —> H2SO4
CH4 + 2O2 —> CO2 + 2H2O
HCOOH + CH3OH —> HCOOCH3 + H2O -
Что понимают под скоростью химических реакций?
-
Определите скорости прямой и обратной реакции в уравнении:
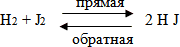
(Vпр = Кпр [Н2] [J2] ; Vобр = Кобр [HJ]²)
II. Информационно-поисковый этап
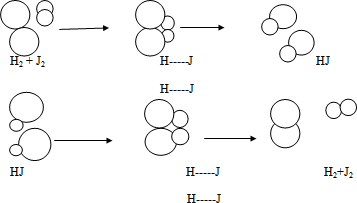
Учитель: В самом начале процесса, пока концентрация исходных веществ высоки, скорость прямой реакции большая, затем она падает. Со временем концентрация вещества Н2 и J2 уменьшается, а концентрация вещества НJ увеличивается. По мере накопления продуктов начинается обратная реакция. Скорость ее возрастает до тех пор, пока не наступает такое состояние, когда расходуется столько молекул продукта, сколько их образуется в прямой реакции. Другими словами, наступает химическое равновесие.
Демонстрируем схему (слайд)
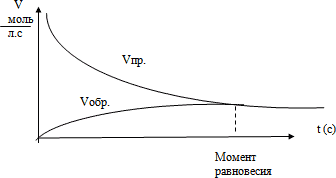
Демонстрируем слайд (график):
Вопросы к учащимся:
-
Что показывает график? Дайте определение понятия «Химическое равновесие»? (График показывает, что в какой то момент скорости прямой и обратной реакции становятся равными. Состояние системы, при которой скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.)
- Выразите это, используя кинетические уравнения для прямой и обратной реакций.
Vпр.= Кпр с (А)ª · с (В)b
V обр. = Кобр с (С)c · с (D)d
Vпр. = Vобр.
Кпр с (А)ª · с (В)b = Кобр с (С)c · с (D)d - Выразите отсюда отношение константа скоростей прямой и обратной реакций.
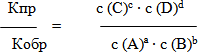
- Как можно назвать отношение констант скоростей прямой и обратной реакции? (Константой равновесия)
Учитель: Константа равновесия обозначается буквой К и показывает, насколько полно протекает прямая реакция до момента наступления химического равновесия. Она показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель) которое устанавливается при равновесии.
Вопросы к учащимся:
- Если константа равновесия больше единицы, что это значит? (Это значит, что на момент установления химического равновесия большая часть исходных веществ превратилась в продукты.)
- А если меньше единицы? (В продукты превратилась меньшая часть исходных веществ.)
Задание классу: Определите константу химического равновесия в химических уравнениях. Ответ мотивируйте.

В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которых находятся в газовой или жидкой фазе.)
Учитель: Состояние равновесия сохраняется сколь угодно долго при неизменных внешних условиях температуре; концентрации, давлении (если в реакции участвуют или образуются газы). Необходимо заметить, что взгляд на химическое равновесие как на подвижное равновесие, возникающее в результате протекания двух взаимно противоположных процессов, впервые высказал французский химик К. Бертолле в 1801-1803 г.г. Спустя 50 лет француз Ф. Малагути предположил, что при химическом равновесии скорости прямой и обратной реакции равны. Дальнейшее развитие представления о химическом равновесии связано с работами французского химика А. Девиля, русского химика Н.Н. Бекетова, норвежских ученых К. Гульдберга и П. Ваге, русского химика А.Л. Потылицына, немецкого ученого Г. Гельмгольца, французского физика-химика Ле Шателье (1884).
С именем французского ученого Ле Шателье связано и название принципа смещения химического равновесия.
Вопросы к учащимся:
- В чем его смысл? (Чем больше действие, тем сильнее противодействие.)
- Сформулируйте этот принцип (при воздействии на равновесную систему извне равновесие смещается в сторону той реакции, которая ослабляет это воздействие)
- Какие факторы влияют на смещение химического равновесия? (Температура, давление, концентрации исходных веществ и продуктов)
(демонстрация слайда)
III. Этап исследования
(Приложение 2).
(работа проводится в группах)
1группа – изучает влияние изменения температуры на смещение химического равновесия.
2 группа – влияние изменения концентрации на смещение химического равновесия.
3 группа – влияние изменения давления на смещение химического равновесия.
Отчеты групп о проделанной работе.
(Демонстрация слайдов)
IV. Этап обобщения и систематизации знаний
-
Влияет ли катализатор на смещение равновесия? (Нет, т.к. одинаково ускоряет прямые и обратные реакции.)
-
Обсуждение вопроса о важности изучения химического равновесия и его смещения для управления химическими реакциями (демонстрация слайдов).
-
Используя принцип Ле Шателье, определите в какую сторону сместится химическое равновесие при повышении или понижении температуры, давления, и концентрации. Определите константу химического равновесия в уравнении?

Самостоятельная работа.
Взаимопроверка через слайд (демонстрация слайда).
V. Этап рефлексии
Учитель: Что нового из сегодняшнего занятия вы для себя получили? (учащиеся высказывают свое мнение).
Подведение итога урока.
Домашнее задание: § 16, повторить § 15 , Упр. 3, 5, 6 стр. 142-143 (УМК О.С. Габриелян 11 класс, базовый уровень).
О. С. Габриелян, Г.Г. Лысова, Химия 11 класс для общеобразовательных учреждений
§ 14, повторить §13, Упр. 1, 2, 4 стр. 147.
(Демонстрация слайда)