Цель урока: развивать у учащихся навыки решения и оформления задач на концентрацию; сформировать общие подходы к решению задач на концентрацию.
Задачи, которые мы будем решать, относятся к традиционным задачам математики. Они охватывают большой круг ситуаций: жидкостей с различным содержанием соли, кислот разной концентрации, сплавление металлов с различным содержанием некоторого металла. Когда-то они имели исключительно практическое значение. В настоящее время эти задачи часто встречаются в тестах на выпускных экзаменах и на вступительных экзаменах в вузы.
Мы рассмотрим задачи на смешение, которые можно решить алгебраическим способом.
Для успешной работы нам понадобится повторить основные понятия этой темы.
Ход урока
I. Фронтальная работа с классом.
1.
Сформулируйте определение концентрации.(Концентрация вещества в смеси – это часть, которую составляет масса вещества в смеси от массы смеси) Нахождение части от целого. В химии вы называли эту величину массовой долей вещества.
Концентрация вещества может быть указана и числом и %.
2
. Объясните значение высказываний:а)
Концентрация раствора 23 %;(В 100 г раствора содержится 23 г вещества).
б)
Молоко имеет 1,8 % жирности;(В100 г молока содержится 1,8 г жира).
в) Сколько сахара содержится в 200 г 10%– го сахарного сиропа?
Теперь давайте попробуем решить устно несколько задач.
3.
К одной части сахара прибавили 4 части воды. Какова концентрация полученного раствора?(1: 5 ·100 = 20 %)
4.
Килограмм соли растворили в 9 л воды. Какова концентрация раствора?(1 : 10 ·100 = 10%)
II. Решение задач
Конечно, вы понимаете, что не все задачи можно решить устно. Следующие задачи мы решим с вами с помощью уравнения.
Рассмотрим решения задач с применением таблицы.
№ 199 Сколько граммов воды надо добавить к 80 % раствора, содержащего 15 % соли, чтобы получить 12 % раствор?
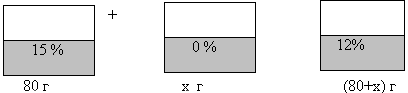
| Наименование веществ, смесей | Масса раствора, г | % содержание (доля) вещества | Масса соли, г |
| I раствор | 80 | 15% = 0, 15 | 0, 15*80 = 12 |
| вода | х | 0% | 0 |
| Новый раствор | (80 + х) | 12% = 0,12 | 0,12*(80 + х) |
0,12*(80 + х) = 12
(80 + х) = 100
Х = 100 – 80
Х = 20 (г) Ответ: надо добавить 20 г воды.
№ 200 Сколько граммов воды надо добавить к 180 г сиропа, концентрация сахара в котором 25%, чтобы получить сироп с концентрацией сахара 20 %?
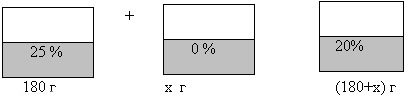
| Наименование веществ, смесей | Масса раствора, г | % содержание (доля) вещества | Масса сахара, г |
| I сироп | 180 | 25% = 0, 25 | 0, 25*180 = 45 |
| вода | х | 0% | 0 |
| Новый сироп | (180 + х) | 20% = 0,2 | 0,2*(180 + х) |
Составим уравнение, используя данные четвертого столбца
0,2*(180 + х) = 45
36 + 0,2х = 45
0,2х = 45 – 36
0,2х = 9
Х = 9:0,2
Х = 45 (г) Ответ: надо добавить 45 г воды.
№ 204 Сколько граммов 30 %-ного раствора надо добавить к 80 г 12 %-ного раствора этой же соли, чтобы получить 20 %-ный раствор соли?
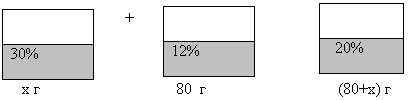
| Наименование веществ, смесей | Масса раствора, г | % содержание (доля) вещества | Масса соли, г |
| I раствор | х | 30% = 0, 3 | 0,3х |
| I I раствор | 80 | 12% = 0,12 | 0,12*80 = 9,6 |
| Новый раствор | (80 + х) | 20% = 0,2 | 0,2*(80 + х) |
Составим уравнение, используя данные четвертого столбца
0,3х + 9,6 = 0,2*(80 + х)
0,3х + 9,6 = 16 + 0,2х
0,3х – 0,2х =16 – 9,6
0,1х = 6,4
Х = 64(г) Ответ: надо добавить 64 г 30 %-ного раствора соли.
№ 205 Два слитка, один из которых содержит 35% серебра, а другой – 65 %, сплавляют и получают слиток массой 20 г, содержащий 47 % серебра. Чему равна масса каждого из этих слитков?
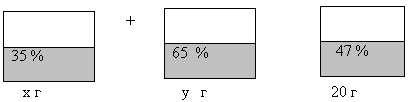
| Наименование веществ, сплава | Масса раствора, г | % содержание (доля) вещества | Масса серебра, г |
| I слиток | х | 35% = 0, 35 | 0,35х |
| I I слиток | (20 – х) | 65% = 0,65 | 0,65(20 – х) |
| Новый сплав | 20 | 47% = 0,47 | 0,47*20 = 9,4 |
Анализируя таблицу, составляем уравнение
0,35х + 0,65(20 – х) = 9,4
0,35х + 13 – 0,65х = 9,4
– 0,3х = 9,4 –13
– 0,3х = – 3,6
Х = – 3,6 : (– 0,3)
Х = 12 (г) 35 %-ного раствора
20 – 12 = 8 (г) 65 %-ного раствора.
Ответ: 12 (г) 35 %-ного раствора; 8 (г) 65 %-ного раствора.
Подведем итог урока. Сегодня мы познакомились с алгебраическим способом решения задач на смешение. Конечно, не все задачи можно решить этим способом, но я думаю, что вам интересно было познакомиться с ним. Дома еще раз осмыслить способ решения и я думаю, что на уроках в 9 классе при подготовке к итоговой аттестации вы успешно примените этот способ.