Применение интегральной технологии представляет большой простор для творчества учителя, позволяет реально дифференцировать процесс обучения. Эта технология позволяет повысить самостоятельность и ответственность учащихся, сделать обучение спокойным, лишенным стрессовых ситуаций. Каждая тема разрабатывается в виде блока уроков. Структура блока подвижна. Вашему вниманию предлагается разработка уроков по теме "Гидроксильные производные". Углубленное изучение химии в классе химико - информационного профиля.
Тема 7. Гидроксильные соединения. 20 часов.
Уроки 1,2.Вводное повторение по теме 7.
На первом уроке предлагается домашнее задание по всей теме. Право выбора уровня обучения предоставляется учащемуся.
Вопросы для повторения.
1. Понятие о спиртах и фенолах, отличие ароматических спиртов от фенолов.
2. Классификация гидроксильных производных по типу углеводородного радикала, числу гидроксильных групп.
3. Электронное и пространственное строение гидроксильной группы.
4. Межмолекулярная водородная связь.
Методы: рассказ, беседа, заполнение таблицы, демонстрация таблиц, моделей. Заполнение сравнительной таблицы.
Д.Модели молекул спиртов и фенолов.
Уроки 3, 4, 5. Изучение основного объёма нового материала по теме 7.
Изучаемые вопросы:
1.Гомологические ряды гидроксильных производных.
2. Изомерия и номенклатура алканолов.
3. Изомерия и номенклатура двух- и трехатомных спиртов.
4.Гомологический ряд фенола, номенклатура.
5.Электронное и пространственное строение фенола. Электронные эффекты гидроксильной группы. Распределение электронной плотности в цикле, граничные структуры.
6.Химические свойства гидроксильных производных. Гидролиз алкоголятов. Реакции электрофильного замещения гидроксильной группы.
7.Особенности химических свойств многоатомных
спиртов.
Методы: лекция с элементами беседы, поисковая
беседа, самостоятельная работа с учебником,
демонстрационные опыты с участием учеников.
Д.1. Растворимость в воде предельных одно- и многоатомных спиртов и фенола.
2.Сравнение взаимодействие натрия с пропанолом и глицерином. 3.Вытеснение фенола из фенолята. 4. Реакция фенола с формальдегидом, щелочами. 5.Качественные реакции на фенол. 6.Распознавание водных растворов фенола и глицерина.
6, 7. Тренинг-минимум по теме 7.
Выполнение упражнений, решение задач в парах постоянного состава с последующим контролем в виде срезовой работы. Во время выполнения упражнений учитель проводит консультации. Выполнение лабораторных опытов.
I. Упражнения.
Задания.
1. Назовите вещества, формулы которых:
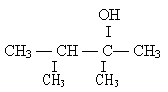
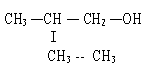
2. Напишите структурные формулы следующих соединений: 2-метилбутанол-1; 2-метилпентанол-2; 2, 2-диметилпропанол-1.
3. Составьте структурные формулы трехатомных спиртов, молекулы которых содержат четыре атома углерода. Назовите все вещества. 4.Составьте структурную формулу 2, 4, 6-тринитрофенола. Для каких целей используют это вещество?
5. Чем отличаются многоатомные спирты от одноатомных: а) по строению; б) по химическим свойствам?
6.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: ацетилен -" этилен -> этанол -" хлорэтан -> этанол -" диэтиловый эфир. 7. Напишите уравнения реакций получения: а) метанола из метана (в 2 стадии); б) 2-хлорпропана из пропанола-2; в) метилэтилового эфира из соответствующих спиртов. 8. С какими из приведенных веществ: иод, водород, натрий, азотная кислота - будет взаимодействовать глицерин? Напишите уравнения возможных реакций.
9. С какими из указанных веществ: гидроксид натрия, хлор, бензол, азотная кислота - будет реагировать фенол? Составьте уравнения возможных реакций и назовите их продукты.
II. Расчетные задачи.
1. Рассчитайте массу алкоголята, которая образуется при взаимодействии калия массой 6 г с пропанолом-1 массой 15 г.
2. При бромировании фенола массой 28,2 г получен осадок массой 79,44 г. Вычислите массовую долю (в %) выхода продукта.
3. Вычислите массу фенолята натрия, полученную при взаимодействии фенола массой 9,4 г с натрием массой 1,6 г.
4. Фенолят калия получен взаимодействием фенола массой 4,7 г и раствора массой 120 г с массовой долей КОН, равной 14%. Какова масса фенолята?
5. Вычислите объем водорода, выделившийся при взаимодействии натрия массой 4,6 г с этиловым спиртом массой 30 г (н. у.).
6. Массовые доли углерода, водорода и кислорода в спирте равны соответственно 52,18, 13,04 и 34,78%. Выведите формулу спирта и вычислите его молярную массу.
III. Лабораторные опыты.
1.Ректификация смеси этанол-вода.
2.Обнаружение воды в азеотропной смеси воды и этилового спирта.
3. Как отличить опытным путем этиленгликоль и этиловый спирт? Опишите ход опыта и предполагаемые наблюдения.
IV. Задания для срезовой работы.
1. Выберите из предложенных структур формулу предельного одноатомного спирта:
а) НО-СН2-СН2-ОН;
б) СН2=СН-СН2-ОН;
в) СН3-СН2-ОН;
г) НО-С6Н5.
2. Какая из предложенных структур представляет третичный спирт:
а) СН3-СН(ОН)-СН3;
б) СН3-СН2-СН2-ОН;
в) СН3-С(СН3)2-ОН;
г) СН3-СН2-ОН.
З. Какова структурная формула соединения пентин-4-ол-2:
а) СН3-ОН;
б) НС=С-СН2-СН(ОН)-СН3;
в) СН3-СН2-ОН;
г) С6Н5-СН2-СН2-ОН.
4. Число изомеров, не являющихся спиртами, у бутанола равно:
а) 4;
б) 3;
в) 2;
г) 1.
5. Способность к образованию водородной связи между молекулами спиртов является причиной:
а) хорошей растворимости в воде;
б) летучести;
в) неэлектропроводности их растворов;
г) наличия запаха.
6. При бромировании фенола избытком брома образуется:
а) 2-бромфенол;
б) 2,3-дибромфенол;
в) 2,5-дибромфенол;
г) 2,3,5-трибромфенол.
7. Одним из реагентов для получения этанола может являться:
а) ацетилен;
б) этилен;
в) уксусная кислота
г) воздух.
8. Веществом X в реакции С2Н5ОН + СН3СООН -" X + Н2О является:
а) этанол;
б) метилэтиловый эфир;
в) пропан;
г) этилацетат.
9. Фенол вступает в химическую реакцию:
а) с оксидом меди (II);
б) с азотной кислотой;
в) с водой;
г) с этиловым спиртом.
10. Выберите из предложенных структур формулу многоатомного фенола:
а) НО-С6Н4-ОН;
б) С2Н5-С6Н4-ОН;
в) С2Н5-С6Н5;
г) С2Н5-С6Н4-С2Н5.
11. Закончите уравнение реакции: С6Н5ОН + NаОН -" ...
Коэффициент перед формулой гидроксида натрия равен:
а) 2;
б) 3;
в) 1;
г) 5.
12. Первичные спирты могут использоваться:
а) в процессе крекинга;
б) для получения сложных эфиров;
в) для синтеза углеводородов;
г) в реакциях полимеризации. |
13. При окислении этанола оксидом меди (П) образуется:
а) формальдегид;
б) ацетальдегид;
в) муравьиная кислота;
г) уксусная кислота.
14. Реактивом на глицерин является:
а) бромная вода;
б) хлороводород;
в) аммиачный раствор оксида серебра;
г) свежеосажденный гидроксид меди(П).
15. Это вещество при обычных условиях жидкое, малорастворимое в воде, но хорошо смешивается со многими органическими растворителями. Взаимодействует с натрием с образованием водорода. При дегидратации образует бутен-2. Это:
а) 2-метилпропанол-2;
б) диэтиловый эфир;
в) бутанол-1;
г) бутанол-2. .. -
16. Какой спирт добавляют к зубной пасте, чтобы предотвратить ее высыхание:
а) этанол;
б) глицерин;
в) метанол;
г) этандиол-1,2.
17. Какой спирт при попадании в организм человека может вызвать слепоту и даже смерть:
а) этанол;
б) глицерин;
в) этиленгликоль;
г) метанол.
18. Простые эфиры являются межклассовыми изомерами:
а) ароматических спиртов;
б) трехатомных спиртов;
в) двухатомных спиртов;
г) одноатомных спиртов.
19. Процентное содержание углерода в молекуле метанола составляет:
а) 37,3%;
б) 37,5%;
в) 37,6%;
г) 37,8%.
20. Для реакции 6,4 г метанола с натрием потребуется:
а) 23 г металла;
б) 2,3 г металла;
в) 46 г металла;
г) 4,6 г металла.
8, 9. Изучение дополнительного объёма нового материала по теме 7.
Изучаемые вопросы.
1. Взаимное влияние атомов в гидроксильных соединениях. Индуктивный и мезомерный эффекты. 2.Сравнение кислотных свойств фенола и спиртов, неорганических и органических кислот.
3.Сравнение кислотно-основных свойств органических и неорганических соединений, содержащих ОН - группу: кислот, оснований, амфотерных соединений (вода, спирты).
4. Простые эфиры и оксиды.
Л.О. 1.Сравнение кислотных свойств фенола и спиртов, неорганических и органических кислот.
Методы: Лекция с элементами беседы, самостоятельная работа учащихся, демонстрация таблиц, выполнение лабораторного опыта.
10, 11. Развивающее дифференцированное закрепление по теме 7.
Основное время на этих уроках занимает индивидуальная или групповая работа учащихся. Группа состоит из 2- 6 человек. Большую часть времени учитель работает с самой многочисленной группой учащихся. К работе могут привлекаться учащиеся - консультанты. Структура первого урока зависит от результатов среза. Если срез выполнили все учащиеся, то начинаем выполнение заданий общего уровня. Если есть учащиеся не выполнившие срез, то их работа направлена на ликвидацию некомпетентности минимума знаний.
Задания общего уровня.
1. Дайте сравнительную характеристику фенола и этанола по плану: а) что общего в строении и какие общие свойства; б) чем различаются их строение и свойства. Ответ подтвердите структурными формулами веществ и уравнениями реакций.
2.Объясните, как смещение электронной плотности влияет на подвижность атома водорода в функциональной группе спиртов по сравнению с другими атомами водорода.
3.Каково влияние бензольного кольца на гидроксильную группу в молекуле фенола? Ответ подтвердите уравнениями реакций. 4.Объясните проявление глицерином слабо выраженных кислотных свойств. Ответ подтвердите уравнениями реакций.
5. Как осуществить превращения, соответствующие схеме:
этан-* бромэтан ---* этанол ---* этилен ---> ацетилен ---> бензол?
Напишите уравнения этих химических реакций, назовите их типы. 6. Какой объем водорода (н. у.) может получиться, если для реакции взять 2,3 г металлического натрия и 5 г этилового спирта?
Задания продвинутого уровня.
1. Напишите структурные формулы этанола, этиленгликоля и фенола. Как изменяется кислотность (подвижность гидроксильных атомов водорода) этих соединений? 2. Почему в отличие от растворов щелочей предельные одноатомные спирты, в состав которых входит функциональная группа - ОН, не изменяют окраски индикаторов и не проводят электрического тока? Какими опытами это можно проверить
3. Сравните химические свойства этанола и этана, Чем объясняется а) сходство и б) различие свойств этих веществ?
4.Где находят применение реакции а) дегидратации и б) дегидратации и дегидрогенизации этилового спирта? Напишите уравнения этих химических реакций, отметьте условия их протекания.
5.Напишите возможные структурные формулы вещества, имеющего состав С2Н6О. Можно ли назвать эти вещества изомерами? Ответ поясните. Как различить эти вещества, если они находятся в склянках без этикеток?
6.При бромировании фенола массой 28,2 г получен осадок массой 79,44 г. Вычислите массовую долю (в %) выхода продукта.
7.Какой объем водорода (н. у.) выделится, если дл реакции взять 57,5 мл абсолютного спирта, плотность которого 0,8 г/мл, и опустить в него 2,1 г металлического лития?=
Задания для желающих.
1.Почему бромирование фенола происходит значительно легче, чем бромирование бензола? Напишите соответствующие уравнения реакций и укажите условия их протекания.
2. Какой спирт называют ректификатом? Как проверить, что выдан а) образец спирта, б) спирт-ректификат? 2. Какой вид химической связи позволяет объяснить отсутствие в гомологическом ряду предельных одноатомных спиртов газообразных веществ?
3.Какие химические свойства можно предположит у вещества, имеющего следующие состав и строение Н2С=СН-СН2ОН? Напишите необходимые уравнения химических реакций.
4.Может ли существовать спирт с двумя гидроксо - группами у одного атома углерода?
5.При взрыве нитроглицерина образуются оксид углерода (IV), азот, кислород и пары воды. Составьте уравнение этой химической реакции.
6.Составьте уравнения химических реакций полного щелочного гидролиза галоидных производных:
а)1,2-дихлорэтана;
б) 1,2,3-трихлорпронана.
Назовите полученные вещества
Уроки 12, 13, 14, 15, 16. Практикум по теме "Гидроксильные соединения".
1.Практическая работа №6 "Изучение растворимости спиртов в воде".
2.Практическая работа №7 "Окисление спиртов различного строения хромовой смесью".
3.Практическая работа № 8 "Получение диэтилового эфира".
4.Практическая работа № 9 "Образование йодоформа из этилового спирта".
5.Практическая работа № 10 "Получение глицерата меди".
17, 18. Обобщающее повторение по теме 7.
Семинарское занятие по теме "Роль гидроксильных производных в жизни человека".
Защита проектов по темам, выбранным самими учащимися. Проекты групповые, полипредметные.
19. Зачетный урок по теме 7.
Это урок контроля знаний. Может быть проведен как контрольная работа или зачет вертушка с блоками теоретического материала и решения задач. Можно провести тестирование учащихся.
20. Урок коррекции знаний по теме "Гидроксильные соединения".
Часть учеников дорабатывают изученный материал. Возможна индивидуальная, парная или групповая работа. Помощь могут оказывать учитель или ученики-консультанты. После этого учащиеся пересдают тему учителю и могут повысить свои отметки. Школьники, не успевшие выполнить какую-то часть на зачетном уроке, имеют возможность продолжить выполнение заданий и также получить более высокие отметки. Учащиеся, получившие на зачетном уроке высший балл, могут быть консультантами для своих товарищей или решать нестандартные задачи.