Цель урока: Обобщить, систематизировать и расширить знания учащихся об окислительно-восстановительных реакциях, важнейших окислителях и продуктах их восстановления.
Задачи:
-
Закрепить умение определять степени окисления элементов, окислитель и восстановитель, расставлять коэффициенты методом электронного баланса.
-
Совершенствовать умение определять окислительно-восстановительные свойства веществ, прогнозировать продукты реакций в зависимости от активности металлов, концентрации кислот и реакции среды раствора.
-
Выработать умение составлять уравнения химических реакций, протекающих в различных средах на примере соединений марганца.
-
Показать разнообразие и значение ОВР в природе и повседневной жизни.
-
Продолжить подготовку к ЕГЭ по химии.
Ход урока
1. Организационный момент
Учитель:
Добрый день! Хорошего вам настроения!Тема нашего урока: «Окислительно – восстановительные реакции» (Приложение 1, слайд 1)
Окислительно-восстановительные реакции принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Важнейшие процессы на планете связаны с этим типом химических реакций. Человечество давно пользовалось ОВР, вначале не понимая их сущности. Лишь к началу XX века была создана электронная теория окислительно – восстановительных процессов. На уроке предстоит вспомнить основные положения этой теории, метод электронного баланса, научиться составлять уравнения химических реакций, протекающих в растворах, и выяснить от чего зависит механизм таких реакций.
2. Повторение и обощение изученного ранее материала
Учитель: Для вас тема ОВР не нова, она проходит красной нитью через весь курс химии. Поэтому предлагаю повторить некоторые понятия и умения по данной теме.
Первый вопрос: «Что такое степень окисления?». Без этого понятия и умения расставлять степени окисления химических элементов не возможно рассмотрение данной темы.
Ученик: Степень окисления – это условный заряд атома химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Степень окисления может быть положительной, отрицательной или равняться нулю, что зависит от природы соответствующих соединений.
Одни элементы имеют постоянные степени окисления, другие — переменные.
Например, к элементам с постоянной положительной степенью окисления относят щелочные металлы: Li+1, Na+1, K+1, Rb+1, Cs+1, Fr+1, следующие элементы II группы периодической системы: Ве+2, Mg+2, Ca+2, Sr+2, Ва+2, Ra+2, Zn+2, а также элемент III А группы - А1+3 и некоторые другие. Металлы в соединениях всегда имеют положительную степень окисления.
Из неметаллов постоянную отрицательную степень окисления (-1) имеет F.
В простых веществах, образованных атомами металлов или неметаллов, степени окисления элементов равны нулю, например: Na°, Al°, Fe°, Н2, О2, F2, Cl2, Br2.
Для водорода характерны степени окисления: +1 (Н20), -1 (NaH).
Для кислорода характерны степени окисления: -2 (Н20), -1 (Н2О2), +2 (OF2).
Следует помнить, что в целом молекула электронейтральна, поэтому в любой молекуле алгебраическая сумма степеней окисления равна нулю, а в сложном ионе – заряду иона.
Например, рассчитаем степень окисления хрома в дихромате калия K2Cr2O7.
-
Степень окисления калия +1, кислорода -2.
-
Подсчитаем число отрицательных зарядов: 7 • (-2) = -14
-
Число положительных зарядов должно быть + 14. На калий приходится два положительных заряда, следовательно, на хром – 12.
-
Так как в формуле два атома хрома, 12 делим на два: 12 : 2 = 6.
-
+ 6 – это степень окисления хрома.
Проверка: алгебраическая сумма положительных и отрицательных степеней окисления элементов равна нулю, молекула электронейтральна.
Учитель: Самостоятельная работа № 1 по инструктивной карте: пользуясь приведенными сведениями, рассчитайте степени окисления элементов в соединениях: MnO2, H2SO4, K2SO3, H2S, KMnO4. (Приложение 2).
Учитель: Что же представляют собой окислительно – восстановительные реакции с точки зрения понятия «степень окисления химических элементов»? (слайд 2)
Ученик: Окислительно – восстановительные реакции – это такие реакции, в которых одновременно протекают процессы окисления и восстановления и, как правило, изменяются степени окисления элементов.
Рассмотрим процесс на примере взаимодействия цинка с разбавленной серной кислотой:

При составлении этого уравнения используется метод электронного баланса. Метод основан на сравнении степеней окисления атомов в исходных веществах и продуктах реакции. Основное требование при составлении уравнений этим методом: число отданных электронов должно быть равно числу принятых электронов.
-
Окислительно - восстановительные реакции – это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
-
Окисление – это процесс отдачи электронов, степень окисления при этом повышается.
-
Восстановление – это процесс присоединения электронов, степень окисления при этом понижается.
-
Атомы, молекулы или ионы, отдающие электроны, окисляются; являются восстановителями.
Атомы, ионы или молекулы, принимающие электроны, восстанавливаются; являются окислителями. -
Окисление всегда сопровождается восстановлением, восстановление связано с окислением.
-
Окислительно – восстановительные реакции – единство двух противоположных процессов: окисления и восстановления.
Учитель: Самостоятельная работа № 2 по инструктивной карте: методом электронного баланса найдите и поставьте коэффициенты в следующей схеме окислительно –восстановительной реакции:
MnO2 + H2SO4 → MnSO4 + O2 + H2O (2MnO2 + 2H2SO4 → 2MnSO4 + O2 +2H2O)
(Приложение 2).
Учитель: Однако научиться находить коэффициенты в ОВР еще не значит уметь их составлять. Нужно знать поведение веществ в ОВР, предусматривать ход реакций, определять состав образующихся продуктов в зависимости от условий реакции.
Ученик: Для того чтобы разобраться, в каких случаях элементы ведут себя как окислители, а в каких – как восстановители, нужно обратиться к периодической системе Д.И.Менделеева. Если речь идет о простых веществах, то восстановительные свойства должны быть присущи тем элементам, которые имеют больший по сравнению с остальными атомный радиус и небольшое (1 - 3) число электронов на внешнем энергетическом уровне. Поэтому они могут сравнительно легко их отдавать. Это в основном металлы. Наиболее сильными восстановительными свойствами из них обладают щелочные и щелочноземельные металлы, расположенные в главных подгруппах I и II групп (например, натрий, калий, кальций и др.).
Наиболее типичные неметаллы, имеющие близкую к завершению структуру внешнего электронного слоя и значительно меньший по сравнению с металлами того же периода атомный радиус, довольно легко принимают электроны и ведут себя в окислительно-восстановительных реакциях как окислители. Наиболее сильными окислителями являются легкие элементы главных подгрупп VI – VII групп, например фтор, хлор, бром, кислород, сера и др.
Вместе с тем надо помнить, что деление простых веществ на окислители и восстановители так же относительно, как и деление на металлы и неметаллы. Если неметаллы попадают в среду, где присутствует более сильный окислитель, то они могут проявлять восстановительные свойства. Элементы в разных степенях окисления могут вести себя по-разному.
Если элемент имеет свою высшую степень окисления, то он может быть только окислителем. Например, в HN+5O3 азот в состоянии + 5 может быть только окислителем и принимать электроны.
Только восстановителем может быть элемент, находящийся в низшей степени окисления. Например, в N-3Н3 азот в состоянии -3 может отдавать электроны, т.е. является восстановителем.
Элементы в промежуточных положительных степенях окисления могут, как отдавать, так и принимать электроны и, следовательно, способны вести себя как окислители или восстановители в зависимости от условий. Например, N+3, S+4 . Попадая в среду с сильным окислителем, ведут себя как восстановители. И, наоборот, в восстановительной среде они ведут себя как окислители.
По окислительно – восстановительным свойствам вещества можно разделить на три группы:
- окислители
- восстановители
- окислители - восстановители
Учитель: Самостоятельная работа № 3 по инструктивной карте: в какой из приведенных схем уравнений реакций MnO2 проявляет свойства окислителя, а в какой – свойства восстановителя:
- 2MnO2 + O2 + 4KOH = 2K2MnO4 + 2H2O (MnO2 – восстановитель)
- MnO2 + 4HCI = MnCI2 + CI2 + 2H2O (MnO2 – окислитель) (Приложение 2).
3. Углубление и расширение знаний
Важнейшие окислители и продукты их восстановления
1. Серная кислота - Н2SO4 является окислителем
А) Уравнение взаимодействия цинка с разбавленной Н2SO4 (слайд 3)
Какой ион является окислителем в данной реакции? (H+)
Продуктом восстановления металлом, стоящим в ряду напряжения до водорода, является H2.
Б) Рассмотрим другую реакцию – взаимодействие цинка с концентрированной Н2SO4 (слайд 4)
Какие атомы меняют степень окисления? (цинк и сера)
Концентрированная серная кислота (98%) содержит 2% воды, и соль получается в растворе. В реакции участвуют фактически сульфат – ионы. Продуктом восстановления является сероводород.
В зависимости от активности металла продукты восстановления концентрированной Н2SO4 разные: H2S, S, SO2.
Чем выше активность металла, тем дальше (глубже) идет восстановление серы (вплоть до низшей степени окисления - 2) (слайд 5)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот (Приложение 3)
2. Другая кислота – азотная – также окислитель за счет нитрат – иона NO3-. Окислительная способность нитрат – иона значительно выше иона H+, и ион водорода не восстанавливается до атома, поэтому при взаимодействии азотной кислоты с металлами, никогда не выделяется водород, а образуются различные соединения азота. Это зависит от концентрации кислоты и активности металла. Разбавленная азотная кислота восстанавливается глубже, чем концентрированная (для одного и того же металла) (слайд 6)
На схемах указаны продукты, содержание которых максимально среди возможных продуктов восстановления кислот (Приложение 3)
Золото и платина не реагируют с HNO3, но эти металлы растворяются в «царской водке» - смеси концентрированных соляной и азотной кислот в соотношении 3 : 1.
Au + 3HCI (конц.) + HNO3 (конц.) = AuCI3 + NO + 2H2O
3. Наиболее сильным окислителем из числа простых веществ является фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и среды.
Создание проблемной ситуации: Я готовила к уроку раствор перманганата калия («марганцовка»), пролила стакан с раствором и испачкала свой любимый химический халат. Предложите (проделав лабораторный опыт) вещество, с помощью которого можно очистить халат.
Реакции окисления – восстановления могут протекать в различных средах. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами: среда влияет на изменение степеней окисления атомов.
Обычно для создания кислотной среды добавляют серную кислоту. Соляную и азотную применяют реже, т.к. первая способна окисляться, а вторая сама является сильным окислителем и может вызвать побочные процессы. Для создания щелочной среды применяют гидроксид калия или натрия, нейтральной – воду.
Лабораторный опыт: (правила ТБ)
В четыре пронумерованные пробирки налито по 1-2 мл разбавленного раствора перманганата калия. В первую пробирку добавьте несколько капель раствора серной кислоты, во вторую – воду, в третью – гидроксид калия, четвертую пробирку оставьте в качестве контрольной. Затем в первые три пробирки прилейте, осторожно взбалтывая, раствор сульфита натрия. Отметьте. Как изменяется окраска раствора в каждой пробирке. (слайды 7, 8) (Приложение 2)
Результаты лабораторного опыта:
Продукты восстановления KMnO4 (MnO4-):
-
в кислой среде – Mn+2 (соль), бесцветный раствор;
-
в нейтральной среде – MnO2, бурый осадок;
-
в щелочной среде - MnO42- , раствор зеленого цвета. (слайд 9, Приложение 3)
К схемам реакций:
KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O
KMnO4 + Na 2SO 3 + H2O → MnO2↓ + Na2SO4 + KOH
KMnO4 + Na 2SO3 + КOH → Na2SO4 + K2MnO4 + H2O
Подберите коэффициенты методом электронного баланса. Укажите окислитель и восстановитель (слайд 10)
(Задание разноуровневое: сильные учащиеся записывают продукты реакции самостоятельно)
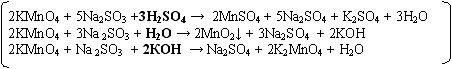
(слайд 11)
Вы проделали лабораторный опыт, предложите вещество, с помощью которого можно очистить халат.
Демонстрационный опыт:
Пятна от раствора перманганата калия быстро выводятся раствором пероксида водорода, подкисленным уксусной кислотой:
2KMnO4 + 9H2O2 + 6CH3COOH = 2Mn(CH3COO)2 +2CH3COOK + 7O2 + 12H2O
Старые пятна перманганата калия содержат оксид марганца (IV), поэтому будет протекать еще одна реакция:
MnO2 + 3H2O2 + 2CH3COOH = Mn(CH3COO)2 + 2O2 + 4H2O (слайд 12)
После выведения пятен кусок ткани необходимо промыть водой.
Значение окислительно – восстановительных реакций
В рамках одного урока невозможно рассмотреть все многообразие окислительно-восстановительных реакций. Но их значение в химии, технологии, повседневной жизни человека трудно переоценить.
Ученик: Окислительно-восстановительные реакции лежат в основе получения металлов и сплавов, водорода и галогенов, щелочей и лекарственных препаратов.
С окислительно – восстановительными реакциями связано функционирование биологических мембран, многие природные процессы: обмен веществ, брожение, дыхание, фотосинтез. Без понимания сущности и механизмов протекания окислительно-восстановительных реакций невозможно представить работу химических источников тока (аккумуляторов и батареек), получение защитных покрытий, виртуозную обработку металлических поверхностей изделий.
Для целей отбеливания и дезинфекции пользуются окислительными свойствами таких наиболее известных средств, как пероксид водорода, перманганат калия, хлор и хлорная, или белильная, известь.
Хлор как сильный окислитель используют для стерилизации чистой воды и обеззараживания сточных вод.
4. Закрепление изученного материала
Тест: (Приложение 2)
-
В кислой среде KMnO4 восстанавливается до:
-
соль Mn+2
-
MnO2
-
K2MnO4
-
-
Концентрированная H2SO4 при обычной температуре пассивирует:
-
Zn
-
Сu
-
AI
-
-
Концентрированная HNO3 не реагирует с металлом:
-
Ca
-
Au
-
Mg
-
-
Разбавленная HNO3 с активными металлами восстанавливается до:
-
NO
-
N2
-
N2O
-
-
Какой продукт восстановления KMnO4 пропущен: 2KMnO4 + 3K2SO 3 + H2O = + 3K2SO4 + 2KOH
-
MnO2
-
2MnSO4
-
K2MnO4
-
(взаимопроверка тестов в парах)
5. Домашнее задание
Используя схемы, данные на уроке, закончите уравнения реакций и расставьте в них коэффициенты методом электронного баланса:
-
AI + H2SO4 (конц.) →
-
Ag + HNO3 (конц.) →
-
KBr + KMnO4 + H2SO4 → …….. + Br2 + K2SO4 + H2O (слайд 13)
6.Подведение итогов урока