Цель урока: Рассмотреть особенности строения и свойства кристаллических и аморфных тел.
Демонстрации:
- Набор кристаллических тел.
- Набор моделей кристаллических решеток.
- Презентация (слайд-шоу).
Ход урока
I. Изучение нового материала.
- План изложения нового материала:
- Твердые тела.
- Кристаллические тела.
- Анизотропия кристаллов.
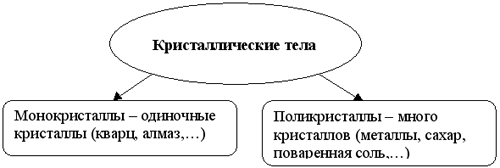
- Монокристаллы и поликристаллы.
- Свойства кристаллических тел.
- Типы кристаллов.
- Аморфные тела.
- Свойства аморфных тел.
- Применение кристаллов.
1. Большинство окружающих нас тел – вещества в твердом состоянии.
Вещества называют твердыми, если они сохраняют свою форму и объем, т. е. внешние признаки.
Специальная область физики “Физика твердого тела” занимается изучением строения и свойств твердых тел. Эта область физики является ведущей во всех физических исследованиях. В любой отрасли техники используются свойства твердого тела: механические, электрические, оптические и т. д.
2. Кристаллы – это твердые тела, атомы или молекулы которых занимают определенные, упорядоченные положения в пространстве.
Правильная внешняя форма не самое главное следствие упорядоченного строения кристалла. Главное – это зависимость физических свойств от выбранного в кристалле направления.
3. Зависимость физических свойств от направления внутри кристалла называют анизотропией (от греческих слов “анизос” – неравный, “тропос” – направление)(слайды).
Все кристаллические тела анизотропны.
4. Слайды 2–6.
5. Свойства кристаллических тел:
- Температура плавления кристаллов – const.
- Все кристаллы анизотропны.
- Каждое кристаллическое вещество имеет свою температуру плавления (слайд 7).
Свойства твердого вещества зависят не только от того, какой у них тип кристаллической решетки. Вещества, сходные по типу элементарных кристаллических ячеек, могут иметь разный характер. Блестящий серебристо-белый титан, к примеру, может кристаллизоваться в гексагональной структуре, напоминающей черно-серый графит, и в объемно-центрированной, как и розоватый натрий.
Большую роль играет также тип связи между компонентами, составляющими тот или иной кристалл, а также особенности структуры их атомов. Силы взаимодействия между частицами в решетках влияют на физико-химические свойства твердого тела.
6. Типы кристаллов:
По характеру взаимодействия между частицами в решетках кристаллические вещества можно разделить на несколько групп:
- атомные кристаллы;
- металлические;
- ионные;
- полупроводниковые;
- молекулярные.
Слайды 8,9.
Атомные кристаллы
. В узлах решеток – нейтральные атомы элементов, связанные за счет обобществления валентных электронов (например, алмаз).Металлические кристаллы
. В узлах решетки – ионы одного и того металла, связанные между собой за счет полусвободных электронов, находящихся в общей для всех ионов зоне проводимости.Ионные кристаллы. В узлах решеток расположены разноименно заряженные ионы, электростатическое притяжение которых определяет характер твердого тела (например, КС1, NaCI).
Полупроводниковые кристаллы. По характеру связи занимают промежуточное положение между атомными и ионными (например, Сu2O).
Молекулярные кристаллы. В узлах решеток – нейтральные молекулы, образующие решетку за счет сил межмолекулярного взаимодействия (например, металлический галлий или твердый СО2).
7. Аморфные тела (от греческого “морфе” – форма и частица “а”, имеющий смысл отрицания) занимают промежуточное положение между кристаллическими твердыми телами и жидкостями (слайды 10–12).
Главный признак аморфного (от греческого "аморфос" – бесформенный) состояние вещества – отсутствие атомной или молекулярной решетки, то есть трехмерной периодичности структуры, характерной для кристаллического состояния.
При охлаждении жидкого вещества не всегда происходит его кристаллизация. при определенных условиях может образоваться неравновесное твердое аморфное (стеклообразное) состояние. В стеклообразном состоянии могут находиться простые вещества (углерод, фосфор мышьяк, сера, селен), оксиды (например, бора, кремния, фосфора), галогениды, халькогениды, многие органические полимеры.
В этом состоянии вещество может быть устойчиво в течение длительного промежутка времени, например, возраст некоторых вулканических стекол исчисляется миллионами лет. Физические и химические свойства вещества в стеклообразном аморфном состоянии могут существенно отличаться от свойств кристаллического вещества. Например, стеклообразный диоксид германия химически более активен, чем кристаллический. Различия в свойствах жидкого и твердого аморфного состояния определятся характером теплового движения частиц: в аморфном состоянии частицы способны лишь к колебательным и вращательным движениям, но не могут перемещаться в толще вещества.
Существуют вещества, которые в твердом виде могут находиться только в аморфном состоянии. Это относится к полимерам с нерегулярной последовательностью звеньев.
Аморфные тела изотропны, то есть их механические, оптические, электрические и другие свойства не зависят от направления. У аморфных тел нет фиксированной температуры плавления: плавление происходит в некотором температурном интервале. Переход аморфного вещества из твердого состояния в жидкое не сопровождается скачкообразным изменением свойств. Физическая модель аморфного состояния до сих пор не создана.
8. Свойства аморфных тел:
Итак, аморфные тела:
- Не имеют постоянной температуры плавления.
- Не имеют кристаллического строения.
- Изотропны.
- Обладают текучестью.
- Имеют только “ближний порядок” в расположении частиц.
- Способны переходить в кристаллическое и жидкое состояние.
Слайд 13.
9. Применение кристаллов (слайды)
Кристаллы традиционно широко используются в ювелирном деле, а в технике они находят все большее применение.
1. Алмаз. Около 80% всех добываемых природных алмазов и все искусственные алмазы используются в промышленности. Алмазные инструменты используются для обработки деталей из самых твердых материалов, для бурения скважин при разведке и добыче полезных ископаемых, служат опорными камнями в хронометрах высшего класса для морских судов и других, особо точных приборах. На алмазных подшипниках не обнаруживается никакого износа даже после 25 млн. оборотов. Высокая теплопроводность алмаза позволяет использовать его в качестве теплоотводящей подложки в полупроводниковых электронных микросхемах.
Конечно, алмазы используются и в ювелирных изделиях – это бриллианты.
Слайд 14.
2. Рубин. Высокая твердость рубинов, или корундов, обусловила их широкое применение в промышленности. Из 1 кг синтетического рубина получается около 40 000 опорных камней для часов Новые перспективы для широкого применения рубинов в научных исследованиях и в технике открылись с изобретением рубинового лазера, в котором рубиновый стержень служит мощным источником света, испускаемого в виде тонкого луча. Слайд 15.
3. Жидкие кристаллы. Это необычные вещества, которые совмещают в себе свойства кристаллического твердого тела и жидкости. Подобно жидкостям они текучи, подобно кристаллам обладают анизотропией.
Наиболее широкое применение жидкие кристаллы получили в буквенно-цифровых индикаторах электронных часов, микрокалькуляторов и т.д. Нужная цифра или буква воспроизводится с помощью комбинации небольших ячеек, выполненных в виде полосок. Каждая ячейка заполнена жидким кристаллом и имеет два электрода, на которые подается напряжение. В зависимости от величины напряжения, “загораются” те или иные ячейки. Индикаторы можно делать чрезвычайно миниатюрными, они потребляют мало энергии.
Жидкие кристаллы применяются в различного рода управляемых экранах, оптических затворах, плоских телевизионных экранах. Слайд 15.
4. Полупроводники. Исключительная роль выпала на долю полупроводниковых кристаллов в современной электронике.
Наиболее характерным свойством полупроводников является резкая зависимость их удельного электрического сопротивления под воздействием различных внешних воздействий: температуры, освещения. На этом явлении основана работа таких приборов, как термисторы, фоторезисторы.
Исключительно малые размеры полупроводниковых приборов, иногда всего в несколько миллиметров, долговечность, связанная с тем, что их свойства мало меняются со временем, возможность легко изменять их электропроводность открывают широкие перспективы использования полупроводников сегодня и в будущем. Слайды 16,17.
5. Вольфрам и молибден. Для работы при высоких температурах широко применяются монокристаллы вольфрама и молибдена, они используются для изготовления сопел реактивных и прямоточных воздушно-реактивных двигателей, обшивок головных частей ракет, ионных двигателей, турбин, атомных силовых установок и во многих других устройствах и механизмах. Поликристаллические вольфрам и молибден применяются для изготовления анодов, катодов, нитей накаливания в лампах, высокотемпературных электрических печей. Слайд 18.
7. Кварц. Это диоксид кремния, один из самых распространенных минералов земной коры. Природные кристаллы кварца имеют размеры от песчинок до нескольких десятков сантиметров, встречаются кристаллы размером до нескольких метров. Чистый кристалл кварца бесцветен. Ничтожные посторонние примеси вызывают разнообразную окраску. В ювелирном деле прозрачные бесцветные кристаллы называют горным хрусталем, фиолетовые – аметистом, дымчатые – раухтопазом и т. д.
Кварц в отличие от стекла хорошо пропускает ультрафиолетовое излучение, поэтому из него изготавливают специальные линзы, применяемые в ультрафиолетовой оптике.
Кварц широко применяется в радиотехнике и электронике – в стабилизаторах частоты (в том числе и в часах), всевозможных фильтрах, резонаторах и т.д.
II. Закрепление изученного материала.
Вопросы:
- Два кубика – один из оконного стекла, другой из монокристалла кварца – опущены в горячую воду. Сохранят ли они свою форму?
- Как исходя из кристаллической структуры твердых тел (например на модели пространственной решетки хлористого натрия) объяснить свойство анизотропии?
Домашнее задание: § 75, 76.