Цели урока:
- Обобщить сведения об углеводородах,
- Проследить зависимость свойств от строения,
- Обобщить знания учащихся о взаимных превращениях углеводородов друг в друга.
Требования: уметь объяснять зависимость свойств углеводородов от их строения.
Элементы содержания: сравнение строения и свойств предельных, непредельных и ароматических углеводородов.
Ход урока
1. Организационный момент.
Учитель демонстрирует карточки с общими формулами углеводородов, формулами важнейших углеводородов и учащиеся называют группу соединения или название вещества и потом занимают свое рабочее место.
2. Проверка домашнего задания.
Опрос по обобщающей таблице “Углеводороды”.
Учащимся предлагается тест по обобщающей таблице. Предлагаю два варианта теста.
1 вариант.
1. Общая формула алканов:
- CnH2n-6
- CnH2n
- CnH2n+2
- CnH2n-2
2. Формула арена, это:
- C7H8
- C5H4
- C5H12
- C4H8
3. Тип гибридизации у алкенов:
- SP
- SP2
- SP3
4. Окончание алкинов:
- ан.
- ен.
- диен.
- ин.
5. В какой формуле 3![]() и 2
и 2![]() – связи:
– связи:
- CH3 – CH3
- H2C = CH2
- HC
 CH
CH - CH4
6. В каких углеводородах есть бензольное кольцо:
- Алкины.
- Арены.
- Циклоалканы.
- Алкадиены.
7. Для каких углеводородов более характерны реакции присоединения:
- Алканы.
- Алкины.
- Арены.
- Циклоалканы.
8. Формула алкана, это:
- C2H4
- C6H6
- C2H6
- C4H6
9. Не обесцвечивают раствор перманганата калия:
- Алкены.
- Алканы.
- Алкины.
- Алкадиены.
10. Не находятся в природе:
- Алканы.
- Алкены.
- Циклоалканы.
- Арены.
2 вариант.
1. Общая формула алкенов:
- CnH2n+2
- CnH2n-6
- CnH2n
- CnH2n-2
2. Формула алкадиена, это:
- C6H6
- C4H6
- C4H10
- C3H6
3. Тип гибридизации у алканов:
- SP
- SP2
- SP3
4. Окончание алкинов:
- ан.
- ен.
- диен.
- ин.
5. В какой формуле 5![]() и 1
и 1![]() – связь:
– связь:
- CH3-CH2-CH3
- H2C = CH2
- CH3-C
 CH
CH - C2H6
6. В каких углеводородах есть тройная связь:
- Алканы.
- Алкены.
- Алкины.
- Арены.
7. Для каких углеводородов характерны реакции замещения:
- Алканы.
- Алкены.
- Арены.
- Алкадиены.
8. Формула алкена, это:
- C3H8
- C3H6
- C5H12
- C5H6
9. Обесцвечивают раствор перманганата калия:
- Алкины.
- Алканы.
- Арены.
- Циклоалканы.
10. Находятся в природе:
- Циклоалканы.
- Алкены.
- Алкины.
Оценка за выполнение теста:
- 10 баллов – отлично;
- 8-9 баллов – хорошо;
- 6-7 баллов – удовлетворительно.
Ответы на тест 1 варианта:
- 3;
- 1;
- 2;
- 4;
- 3;
- 2;
- 3;
- 3;
- 2;
- 2.
Ответы на тест 2 варианта:
- 3;
- 2;
- 3;
- 4;
- 2;
- 3;
- 1;
- 2;
- 1;
- 1.
Учащиеся осуществляют взаимоконтроль и выставляют друг другу оценку за выполнение теста.
3. Основная часть урока.
1. Работа в группах.
Каждой группе дается цепочка химических превращений с углеводородами.
1 группа.
Метан —> ацетилен —> этилен —> этанол —> бутадиен-1,3 —> бутадиеновый каучук.
2 группа.
Пропан —> 1-хлорпропан —> гексан —> циклогексан —> бензол.
3 группа.
Хлорэтан —> этилен —> 1,2-дихлорэтан —> ацетилен —> уксусный альдегид.
4 группа.
Метан —> ацетилен —> бензол —> толуол —> бензойная кислота.
5 группа.
Этан —> хлорэтан —> бутан —> бутадиен-1,3 —> бутадиеновый каучук.
6 группа.
Этанол —> этилен —> этан —> этилен —> полиэтилен.
Каждая группа пишет уравнения реакций на доске и указывает условия протекания реакций.
После анализа цепочек превращений с углеводородами составляется схема генетической взаимосвязи углеводородов:
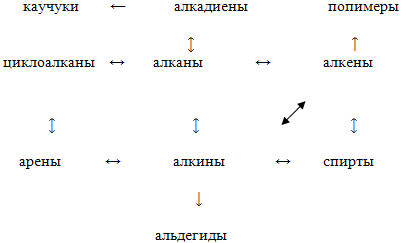
2. Решение задач.
Каждой группе предлагается три задачи.
- Задача на вывод формулы по массовой доле.
- Задача на вывод формулы по продуктам сгорания.
- Задача по уравнению в общем виде.
Примерные варианты задач:
- Найти молекулярную формулу органического вещества, содержащего 52,17%С,13,05%Н и 34,78%О.Плотность вещества по водороду равна 23.
- При сгорании органического вещества массой 1,5г получили 1,12л оксида углерода(IY ) и 0,9г воды. Плотность органического вещества по водороду равна 15. Найти формулу органического вещества.
- На полное гидрирование 2,8г алкена израсходовано 0,896л водорода.Какова молекулярная масса и структурная формула этого соединения, имеющего нормальную цепь углеродных атомов.
Проверка задач через кодоскоп и выставление оценок.
3. Указать характерные реакции для каждого класса углеводородов и заполнить таблицу.
| Реакции | Алканы | Алкены | Алкадиены | Алкины | Циклоалканы | Арены |
| Замещения | ||||||
| Присоединения | ||||||
| Полимеризации | ||||||
| Дегидрирование | ||||||
| Изомеризации | ||||||
| Окисления |
Обсуждение заполненной таблицы, выступление групп.
4. Заполнить таблицу и указать виды изомерии, характерные для данного класса углеводородов.
| Углеводороды | Изомерия углеродной цепи | Изомерия положения кратной связи | Межклассовая изомерия | Пространственная изомерия (цис-,транс-,изомерия) |
| Алканы | ||||
| Алкены | ||||
| Алкадиены | ||||
| Алкины | ||||
| Циклоалканы | ||||
| Арены |
Обсуждение заполненной таблицы, выступление групп.
4. Закрепление. Самостоятельная работа.
1. Ниже приведены формулы предельных и непредельных углеводородов. Разделите их на группы: а) предельные б) непредельные:
- С4Н10;
- С2Н6;
- C5H10;
- C5H12;
- C2H4.
2. Какие из веществ данного состава могут иметь изомеры:
- C2H6;
- C3H8;
- C5H12;
- C4H8;
- C3H6;
- C6H12.
3. Даны формулы углеводородов: C2H4; C2H2; C2H6; C3H8; C3H6.
Для каких углеводородов характерна:
- Реакция отщепления водорода.
- Реакция замещения.
- Реакция окисления.
- Реакция присоединения.
В оставшееся время разыгрывается 5 баллов:
Получить дивиниловый каучук из карбида кальция, используя неорганические вещества
5. Подведение итогов урока.
6. Домашнее задание.