Цели урока:
Образовательные:
- актуализировать знания учащихся о положении элемента кислорода в ПСХЭ Д.И. Менделеева;
- познакомить учащихся с историей открытия кислорода;
- дать понятие о кислороде как о химическом элементе и простом веществе: нахождение в природе, химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами; применение кислорода.
- актуализировать понятия: горение и медленное окисление, дыхание и фотосинтез;
- дать понятие о способах получения кислорода и биологическом значении кислорода.
- ввести понятие «катализатор»
Развивающие:
- развивать речь учащихся, память;
- развивать логическое мышление, умение анализировать, делать выводы;
- развивать общеучебные компетенции: умение слушать, делать записи, применять полученные знания в практической деятельности.
Воспитательные:
- формировать естественно-научное мировоззрение учащихся;
- воспитывать положительное отношение к предмету;
- поддерживать интерес к науке «химия».
Тип урока: урок сообщения новых знаний (урок – путешествие)
Формы и методы работы на уроке: фронтальный, объяснительно – иллюстративный, наглядный, эксперимент, работа с дидактическим материалом, ИКТ
Оборудование:
- ТСО – телевизор, видеомагнитофон, компьютер, проектор, экран.
- ПСХЭ Д. И. Менделеева;
- Прибор для получения кислорода разложением перманганата калия и собирания кислорода способом вытеснения воды -1 шт.
- Прибор для получения кислорода каталитическим разложением пероксида водорода и собирания кислорода способом вытеснения воздуха – 1шт.
- Спиртовка, спички, лучинка.
- Дидактический материал к уроку – маршрут урока – план урока для учащихся (Приложение 1)
Реактивы: перманганат калия, пероксид водорода, оксид марганца (IV), уголек древесный, известковая вода, сера.
Ход урока
I. Организационный момент.
- Подготовка учащихся к уроку.
- Приветствие.
- Отсутствующие.
II. Мотивация познавательной деятельности
Сообщение темы и целей урока.
Учитель: Сегодня мы совершим путешествие по удивительной стране «Кислород», побываем на многих станциях, узнаем много интересного об этом элементе и веществе.
Перед нами сегодня стоят следующие цели: слайд-презентация. (Приложение 2)
Сообщение нового материала по плану:
1) Станция «Менделеевская»
Актуализация понятия «Положение элемента кислорода в ПСХЭ Д.И. Менделеева» – фронтальная беседа с классом + индивидуальная работа учащихся с ПСХЭ Д.И. Менделеева + работа на доске + работа учащихся в тетради по актуализации понятия + слайд- презентация. (Приложение 2)
Назовите положение элемента кислорода в ПСХЭ Д.И. Менделеева»
- Порядковый номер
- Массовое число
- Номер периода
- Номер группы
Напишите схему строения атома кислорода – 1 ученик чертит схему строения на доске.
Назовите элементы, которые входят в VI А группу.
Учитель: Элементы этой подгруппы: кислород, сера, селен, теллур имеют общее название «халькогены», что означает в переводе с греческого «рождающие руды».
А ведь и в самом деле основные руды, используемые в металлургической промышленности, представляют собой соединения родоначальников подгруппы кислорода – оксиды:
а) Красный железняк (гематит) – Fe2O3
б) Бурый железняк (лимонит) - 2Fe2O3 ∙ 3 Н2О
в) Магнитный железняк (магнетит) – Fe3O4
и серы:
г) Железный колчедан (пирит) – FeS2
д) Медный колчедан- CuFeS3
е) Цинковая обманка – ZnS
ж) Свинцовый блеск - PbS
Мы с вами уже изучали некоторые руды, в состав которых входят эти элементы (при изучении темы «Железо»)
2) Станция «Историческая» - история открытия кислорода. (Приложение 2)
Рассказ ученика + слайд – презентация
«Кислород открыли и впервые получили почти одновременно два выдающихся химика XVIII века – швед Карл Шееле путем нагревания селитры и англичанин Джозеф Пристли.
Джозеф Пристли нагревал красный оксида ртути (II) в солнечных лучах, сфокусированных линзой. Пристли собрал полученный газ над ртутью, внес в него слабо горящую свечу, тлеющую лучинку и нагретую железную проволоку. Свеча в полученном газе загоралась ярко, лучинка вспыхивала, проволока начинала светиться.
Шееле получил кислород раньше, чем Пристли, но результаты опытов Пристли стали известны сразу же, а труды Шееле значительно позже.
Пристли изучал «связанный воздух» или углекислый газ и обнаружил то, что в присутствии зеленых веток этот газ после пребывания на свету становился пригодным для горения и дыхания.
Классический опыт Пристли, во время которого умирающие мыши оживали после внесения под колпак зеленых веток, ученые смогли объяснить лишь после создания учения о фотосинтезе.
Истинную природу кислорода, его роль в химических реакциях и название элементу дал великий французский химик Антуан Лавуазье: oxygenium - т.е. «рождающий кислоты», или «кислород».
В 1775 году Антуан Лавуазье установил, что кислород – это составная часть воздуха», как химический элемент кислород содержится во многих веществах, находящихся в природе.
3) Станция «Природа» (Приложение 2)
Учитель:
- На этой станции мы с вами познакомимся с нахождением этого удивительного и очень важного для всех нас элемента и вещества – кислород в природе.
- Слайд-презентация и чтение стихотворения «Кислород» учащимся.
Из атомов мир создавала Природа,
Два атома легких взяла водорода,
Прибавила атом один кислорода-
И получилась частичка воды,
Море воды, океаны и льды…
Стал кислород
Чуть не всюду начинкой
С кремнием он обернулся песчинкой.
В воздух попал кислород.
Как ни странно,
Из голубой глубины океана.
И на земле появились растения,
Жизнь появилась:
Дыхание, горение…
Первые птицы и первые звери,
первые люди, что жили в пещере…
Огонь добывали при помощи трения,
Хоть и не знали причины горения.
Роль кислорода на нашей Земле
Понял великий Лавуазье.
Рассказ учителя + слайд – презентация.
Кислород – самый распространенный химический элемент на нашей планете. Он входит в состав воды - 88,9%, в состав многочисленных минералов – 49,6% (в составе земной коры).
Как простое вещество кислород входит в состав атмосферы ≈ 21 % - по объему.
Как химический элемент кислород образует две аллотропных модификации – кислород с молекулярной формулой О2 и озон с молекулярной формулой – О3, которые резко отличаются друг от друга по свойствам.
4) Станция «Химическая лаборатория» (Приложение 2)
Учитель: На этой станции мы побываем с вами в химической лаборатории и узнаем, а также и повторим сведения о том, как же можно получить такое замечательное вещество – кислород в нашем химическом кабинете.
В 8 классе при изучении темы «Простые вещества» мы говорили о кислороде и способах его получения и собирания. Мы получали кислород из перманганата калия. Сегодня мы это вспомним, а также узнаем много нового.
Способы получения кислорода и собирания в лаборатории – демонстрационные опыты, Приложение 3.
Опыт № 1. Разложение пероксида водорода в присутствии оксида марганца (IV) и собирание кислорода способом вытеснения воздуха.
![]()
MnО2 – катализатор – т.е. вещество, которое увеличивает скорость протекания химической реакции (записать определение в тетрадях).
Опыт № 2. Разложение перманганата калия и собирание кислорода способом вытеснения воды – актуализация понятия.
![]()
Вывод – формулируют учащиеся по опорным вопросам:
- Агрегатное состояние кислорода…
- Цвет…
- Запах
- Растворимость в воде…
Плотность по отношению к воздуху… ![]()
Способы собирания кислорода…
Кислород – это газ без цвета, запаха, малорастворимый в воде, чуть тяжелее воздуха.
Кислород можно собирать способом вытеснения воды т.к. кислород в воде малорастворим и способом вытеснения воздуха, т.к. кислород чуть тяжелее воздуха (Мr(возд) = 29) < Мr (O2) = 32)
Получение кислорода в промышленности – актуализация понятия – работа с рис.39, стр.92, О.С. Габриелян, М., Дрофа, 2007 г, «Перегонка воздуха» + видеофрагмент «Перегонка воздуха».
Учитель: Кислород в промышленности получают перегонкой жидкого воздуха.
При охлаждении и сжатии воздуха при помощи компрессора:
- первым испаряется азот, ιº(кип. ж. N2) = -196 ºC
- вторым испаряется аргон ιº(кип. ж. Аr) = -186 ºC
- третьим испаряется кислород ιº(кип. ж. О2) = -183 ºC
5) Станция «Химические превращения» - химические свойства кислорода - демонстрационные опыты + составление таблицы учащимися в тетради с написанием уравнений реакций на доске одним из учащихся + названия продуктов реакций, рассмотреть реакции с точки зрения ОВР + значение кислорода + слайд презентация с демонстрацией готовой таблицы (Приложение 2, Приложение 3)
Химические свойства кислорода |
Значение кислорода |
1. С простыми веществами С0 + О20 = C +4О2-2 + Q S0 + О20 = S+4О2-2+ Q 3Fe0 + 2О20 = Fe3+2,+3О4-2 + Q 4Al0 + 3О20 = 2Al2+3О3-2+ Q 2. Со сложными веществами C-4H4+1 + 2О20 = C+4О2-2 + 2Н2+1О-2 + Q 2H2+1S-2 + 3О20 = 2S+4О2-2+ 2Н2+1О-2+ Q |
1. Реакции горения – это такие реакции, которые сопровождаются выделением тепла и света. 2. Реакции окисления – это такие реакции, которые протекают с участием кислорода:
|
6) Станция «Практическая» - применение кислорода в практической деятельности человека – работа учащихся с текстом учебника, стр.127 – 128 + работа учащихся в тетрадях по составлению схемы «Применение кислорода» _ слайд - презентация (Приложение 2)

III. Закрепление – работа учащихся по осмыслению полученных знаний – работа с кроссвордом по теме «Кислород» (Приложение 1)
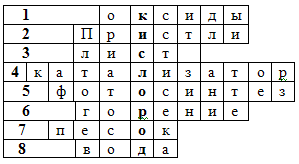
По горизонтали:
- Соединенения, состоящие из двух элементов, одним из которых является кислород (оксиды)
- Фамилия английского ученого, получившего кислород разложением оксида ртути (II) (Пристли)
- Орган растения, где образуется кислород (лист)
- Вещество, ускоряющее химическую реакцию (катализатор)
- Процесс образования кислорода на свету (фотосинтез)
- Реакция окисления, которая сопровождается выделением тепла и света (горение)
- Вещество, в состав которого входит элемент кислород (песок)
- Самое распространенное вещество на Земле, в состав которого входит кислород (вода)
Ключевое слово - самый распространенный химический элемент на Земле (кислород)
IV. Рефлексия.
- Что нового вы узнали сегодня на уроке?
- В чем испытывали затруднения?
- Что понравилось на уроке?
V.Домашнее задание: § 21 №№ 1-3 (письменно) + презентация тем (по выбору учащихся)
- Кислород и озон
- Фотосинтез
- Круговорот кислорода в природе
УМК и литература
- О.С.Габриелян «Программа курса химии для 8 – 11 классов общеобразовательных учреждений, базовый уровень» М.: «Дрофа», 2007 год.
- Габриелян О.С. «Химия – 9». Учебник для общеобразовательных учреждений – М.: Дрофа, 2007
- О.С. Габриелян, Химия 9 кл. «Настольная книга учителя». – М.: Дрофа, 2006
- Химия «Поурочные планы по учебнику О.С.Габриеляна», автор-составитель В.Г.Денисова. – Волгоград: Учитель, 2005.
- В.С.Полосин, Школьный эксперимент по неорганической химии,1972
- CD «Химия элементов»
- Энциклопедический словарь юного химика, М. «Педагогика»,1982
- Школьная энциклопедия, Химия, М., «Дрофа», 2000
- Хрестоматия по неорганической химии, М., «Просвещение», 1985
- А.А. Штемплер, Загадки, ребусы, кроссворды, М. «Просвещение» 2000