Цели урока. Рассмотреть нахождение воды в природе. Ознакомить учащихся со способами получения чистой воды и проблемой сохранения водных ресурсов. Повторить, систематизировать и углубить знания учащихся о составе, физических и химических (окислительно-восстановительных свойствах воды). Сформировать умения предсказывать окислительно-восстановительные свойства вещества, опираясь на его состав.
Демонстрации: модель молекулы воды, взаимодействие натрия и оксида кальция с водой, мультимедийная презентация.
Ход урока
Организационный момент.
Вступительное слово учителя.
Ребята, позвольте мне зачитать несколько цитат из высказывания величайших людей своего времени:
- Эмиль Дюбуа: “Жизнь есть одушевленная вода”;
- Леонардо да Винчи: “Воде была дана волшебная власть стать соком жизни на Земле”;
- Антуан де Сент-Экзюпери: “Вода! Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое! Нельзя сказать, что ты необходима для жизни: ты – сама жизнь. Ты наполняешь нас радостью, которую не объяснить нашими чувствами..... Ты самое большое богатство на свете....”
- И.В. Петряков – Соколов: “ Нет предела человеческому разуму, нет предела его возможностям; и то, что мы теперь так знаем о природе и свойствах поистине самого удивительного в мире вещества – о воде, открывает.... еще большие, неограниченные возможности.
И вот о том, что такое вода и какие возможности открывает изучение свойств воды мы с вами и поговорим. Приложение 1 Слайд 1 Оксид водорода – вода.
Сегодня на уроке мы рассмотрим следующие вопросы: (Слайд 2)
- Нахождение воды в природе, распределение воды на Земле.
- Круговорот воды в природе.
- Физические свойства воды.
- Очистка вод
- Химические свойства воды.
К сегодняшнему уроку вы получили домашнее задание самостоятельно разобрать и сделать сообщение на тему “Нахождение воды в природе, распределение воды на Земле”, “Круговорот воды в природе”, “Очистка вод”.
Выступления учащихся: 1.Доклад на тему “Вода в природе. Распределение воды на Земле”,(Слайды 4-7); 2. “Круговорот воды в природе”(Слайд 8) рассказывают учащиеся, сопровождая презентацией;
Что же такое вода? (Слайд 9-10)Несмотря на то, что вы не изучали эту тему подробно, я думаю, что вы знаете формулу воды? Какова она? Из каких атомов состоит молекула воды?(Демонстрация шаростержневой модели воды). Каковы физические свойства воды? Вы вероятно знаете их из курса физики.(при н.у. вода жидкость, без цвета, запаха и вкуса, tкип.= 100◦С, tзамерз= 0◦С, p= 1г/мл). Это характеристика химически чистой воды. Вода, которая не содержит никаких примесей. Есть вода чистая, люди ее используют для своих хозяйственных нужд, эта вода содержит в своем составе допустимые растворимые вещества. Но из-за хозяйственной деятельности в природе не всегда вода чистая. Поэтому, прежде чем она попадает к нам по водопроводу эту воду необходимо очистить.
- Очистка водопроводной воды (рассказ, слайд 11)
- Дистилляция (рассказ, слайд 12)
Строение молекулы воды.
А какой тип связи в молекуле воды? (Рассказ учителя о полярности молекулы воды, диполи воды, ассоциации молекул. Демонстрация, слайд 13-15 )
Далее разберем химические свойства воды, т.е. реакции в которые она может вступать. Благодаря биполярности вода может растворять многие вещества с ковалентной полярной и ионной связью (кислоты, соли, основания),(Слайд 16), но, кроме того, вода может и являться реагентом в различных химических реакциях.
- Вода реагирует с активными металлами (щелочными и щелочноземельными). Демонстрация опыта: “Взаимодействие натрия с водой”. Учитель записывает на доске схему уравнения химической реакции. Просит учащихся самостоятельно дописать уравнение реакции, затем те ребята проверяют свои записи с уравнением на экране, то же задание с магнием. (Слайд 17)
- Вода взаимодействует с сильнейшим окислителем, как фтор. Демонстрация видео-опыта. (Слайд 18). Запись схемы уравнения химической реакции.
- Вода вступает в реакции с соединениями: (Слайд 19) а) с оксидами активных металлов, образуя растворимые основания (щелочи) Лабор.опыт выполняют учащиеся: “Взаимодействие оксида кальция с водой”. Записывают уравнение реакции. б) с кислотными оксидами с образованием соответствующих кислот. Демонстрация видео-опыта. (Слайд 20) .
- Вода с некоторыми солями образует кристаллогидраты. Демонстрация безводного сульфата меди (II), при дбавление воды образуется пятиводный кристаллогидрат. Существуют и другие кристаллогидраты.(Слайд 21)
- Вода способна в незначительной степени диссоциировать на ионы (примерно одна молекула из 108) Н2О ↔Н+ + ОН-
Закрепление.
1) Зная, что вода реагирует с активными металлами с образованием растворимых в воде оснований (щелочей), с основными и кислотными оксидами допишите уравнения химических реакций (Слайд 22)
1 вариант– нечетные номера; 2 вариант– четные:
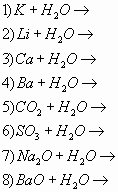
Определите, какие из них являются ОВР, для них напишите уравнение электронного баланса, укажите окислитель, восстановитель и процессы окисления и восстановления.
2) Определите массовые доли водорода и кислорода в молекуле воды.(Слайд 23)
3) Задача. К 200 г раствора, массовая доля вещества в котором 0,3, добавили 100 г воды. Вычислите массовую долю растворенного вещества в полученном растворе.(Слайд 24)
Домашнее задание: учебник И.И.Новошинский, Н.С.Новошинская § 12, № 7, 8 стр. 59, (Слайд 25)
1. темы докладов и сообщений:
“Аномальные свойства воды”
“Значение воды для живых организмов”
“ Охрана водных ресурсов”
“ Всегда ли вода Н2О? Что такое тяжелая вода?”
2. Для творческих людей, если будет вдохновение написать стихи о воде.