Цель урока:
- Способствовать формированию у учащихся знания молекулярно-кинетической теории идеального газа;
- Выявить причинно-следственные связи между величинами, входящими в уравнение;
- Сформировать понятие изопроцесс;
- Создать условия для выявления качества и уровня овладения знаниями и умениями с использованием компьютерных технологий.
Цели, ориентированные на развитие личности учащегося:
- Способствовать эмоционально-ценностному отношению к физическим явлениям в природе.
- Создать позитивные условия для проявления познавательного интереса у учащихся, желания самостоятельного поиска знаний и развития творческого мышления.
Воспитательные цели:
- Выявить взаимосвязь теории и эксперимента как критерия истины. Продолжить работу по развитию мышления и мировоззрения школьников.
- Содействовать осознанию учащимися ценностей совместной деятельности на уроке.
Структура урока:
- Актуализация знаний.
- Объяснение нового материала.
- Закрепление.
- Домашнее задание.
Единый план изучения газовых законов:
- Определение и условия осуществления процесса.
- Уравнение и формулировка закона.
- Экспериментальное исследование справедливости закона.
- Графическое изображение процесса.
- Границы применимости закона.
Основные понятия урока: изопроцессы, изотермический, изобарный, изохорный, изотерма, изобара, изохора.
Ход урока
I. Организационный момент
Слайды №1 – №7 (приложение 1)
Сообщение целей и задач урока.
II. Актуализация знаний
Проверка домашнего задания
- Каковы нормальные условия для идеального газа?
- Какова концентрация молекул идеального газа при нормальных условиях?
- Какие макроскопические параметры связывает уравнение Клайперона – Менделеева?
- Какие параметры надо знать для определения состояния идеального газа?
III. Объяснение нового материала
Если одновременно меняются все характеристики идеального газа, то трудно установить какие-либо закономерности. Поэтому будем изучать процессы, в которых масса и один из трех параметров – p, V или T - остаются неизменными.
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Первый газовый закон был открыт английским ученым Р. Бойлем. Работа называлась «Новые эксперименты, касающиеся воздушной пружины». Бойль изучал давление газа в зависимости от объема при постоянной температуре. Данный процесс называется изотермическим.
Независимо от Бойля несколько позднее французский ученый Э. Мариотт пришел к тем же выводам. Поэтому закон получил название Бойля Мариотта. Выполним эксперимент, применяя установку L – микро (слайды №9 - №11). В этом эксперименте, изменяя значение объема, получаем соответствующие давления и составляем таблицу, из которой видно, что p1V1 = p2V2 = p3V3 = const (Рисунок 1).
|
P, кПа |
200 |
160 |
120 |
80 |
40 |
|
V, см3 |
34,1 |
42,6 |
56,8 |
85,3 |
170,5 |
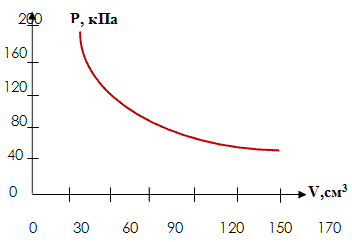
Рисунок 1
Теперь давайте сформулируем изотермический закон:
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется.
А сам процесс изменения состояния термодинамической системы при постоянной температуре называется изотермическим процессом.
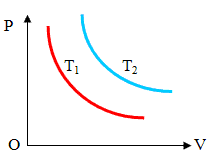
Рисунок 2
Зависимость давления
газа от объема при постоянной температуре графически изображается кривой,
которая называется изотермой. Изотерма газа изображает обратно пропорциональную
зависимость между давлением и объемом. Кривую такого рода в математике называют
гиперболой. Разным постоянным температурам соответствуют различные изотермы. При
повышении температуры давление согласно уравнению состояния
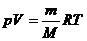 увеличивается, если V = const. Поэтому изотерма,
соответствующая более высокой температуре Т2, лежит выше
изотермы, соответствующей более низкой температуре Т1 (Рисунок
2).
увеличивается, если V = const. Поэтому изотерма,
соответствующая более высокой температуре Т2, лежит выше
изотермы, соответствующей более низкой температуре Т1 (Рисунок
2).
Изотермическим процессом приближенно можно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда.
Провожу закрепление нового материала: Мини-тест, решение задач
(слайды № 12 -№13 ).
Следующий закон называется законом Гей-Люссака и происходит при постоянном объеме.
Вывод и исследование
этого закона проводим с помощью установки L – микро (слайды №14
-№16) . В результате эксперимента получаем таблицу и график
зависимости (V, T) откуда видно, что 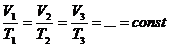 (Рисунок 3 )
(Рисунок 3 )
|
V, см3 |
486 |
405 |
324 |
216 |
162 |
81 |
0 |
|
Т, 0К |
360 |
300 |
240 |
180 |
120 |
60 |
0 |
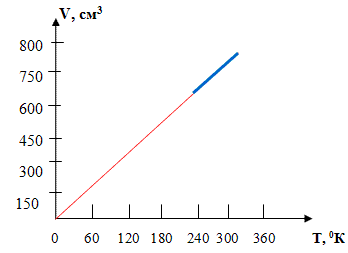
Рисунок 3
Теперь давайте, ребята, вместе сформулируем закон Гей-Люссака:
Для газа данной массы отношение объема к температуре постоянно, если давление газа не изменяется.
Сам же процесс изменения состояния термодинамической системы при постоянном давлении называется изобарным.
Объем данной массы газа
при р = const зависит от температуры по линейному закону 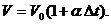
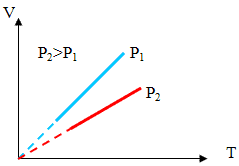
Рисунок 4
Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля-Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению (Рисунок 4)
В области низких
температур все изобары идеального газа сходятся в точке Т = 0. Но это не
означает, что объем реального газа действительно обращается в нуль. Все газы
при сильном охлаждении превращаются в жидкости, а к жидкостям уравнение
состояния 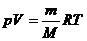 неприменимо.
неприменимо.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Провожу закрепление нового материала: Мини-тест, решение задач (слайды № 17 - №18).
При V = const давление данной массы
газа при постоянном объеме зависит от температуры по линейному закону:
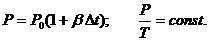
Для доказательства данного правила опять воспользуемся установкой L – микро (слайды № 19 - №20).
В результате
эксперимента получаем таблицу и график зависимости (Р, T) откуда видно, что
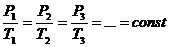 (Рисунок 5)
(Рисунок 5)
|
Р, кПа |
117 |
97,5 |
78 |
58,5 |
39 |
19,5 |
0 |
|
Т, 0 К |
360 |
300 |
240 |
180 |
120 |
60 |
0 |
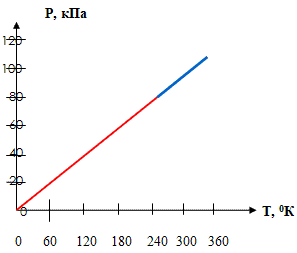
Рисунок 5
Теперь давайте, ребята, вместе сформулируем закон Шарля:
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Сам же процесс изменения состояния термодинамической системы при постоянном объеме называется изохорным.
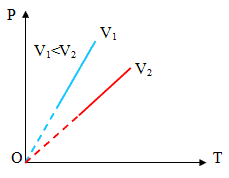
Рисунок 6
Эта зависимость давления от температуры изображается прямой, называемой изохорой. Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление согласно закону Бойля – Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1. В соответствии с законом Шарля все изохоры начинаются в точке Т = 0. Значит, давление идеального газа при абсолютном нуле равна нулю.
Увеличение давление газа в любой емкости или в электрической лампочке при нагревании является изохорным процессом. Изохорный процесс используется в газовых термометрах постоянного объема.
Провожу закрепление нового материала: Мини-тест, решение задач (слайды № 21 -№22).
IV. Структурированный комплексный тест по всем газовым законам
Тест составлен в EXSEL (приложение 2). Программа сразу же автоматически выставляет полученную оценку и указывает на ошибки. Причем она позволяет при соответствующем навыке работы с ней исправлять эти ошибки. Это вырабатывает у учащихся уверенность в своих в себе, веру в свои знания, повышает познавательный интерес.
V. Домашнее задание
На рисунке (смотри слайд №26) дан график изменения состояния идеального газа в координатных осях V, T. Представьте этот процесс в координатных осях P, T и P, V.