Цель урока. Конкретизировать знания о химическом элементе и простом веществе. Изучить физические свойства кислорода. Сформировать представления о способах получения и собирания кислорода в лаборатории.
Задачи:
- Образовательные:
– Уметь различать понятия “химический элемент” и “простое вещество”
на примере кислорода.
– Уметь характеризовать физические свойства кислорода и способы
собирания кислорода.
– Уметь расставлять коэффициенты в уравнениях реакций. - Воспитательные:
формирование аккуратности при выполнении лабораторного опыта;
внимательности, бережного отношения. - Развивающие:
– Формирование выстраивания логических цепочек, владеть химической
терминологией, познавательной активности, умозаключений и суждений.
Основные понятия. Химический элемент, простое вещество, физические свойства, катализаторы.
Планируемые результаты обучения. Уметь различать понятия “химический элемент” и “простое вещество” на примере кислорода. Уметь характеризовать физические свойства кислорода и способы собирания кислорода. Уметь расставлять коэффициенты в уравнениях реакций.
Опыт: Получение кислорода из пероксида водорода и подтверждение его наличия.
Демонстрации. Получение кислорода из перманганата калия. Собирание кислорода методом вытеснения воздуха и подтверждение его наличия.
Оборудование и реактивы: Таблица Д.И.Менделеева, раздаточный материал (тест), прибор для получения кислорода из пермангата калия (коническая колба с резиновой пробкой, газоотводная трубка, ПХ-12, штатив, лапка, вата), пероксид водорода 20 мл (15 флаконов), оксид марганца (IV) (15 склянок), ложка-дозатор (15 шт.), спиртовка (15 шт.), спички (15 шт.), лучина (15 шт.), перманганат калия (5 г),.
Тип урока: Урок усвоения новых знаний.
Методы обучения:
- Объяснительно-иллюстративный (словесные: беседа, изложение; словесно-наглядные: самостоятельная работа учащихся с наглядными пособиями; словесно-наглядно-практические: работа учащихся с раздаточным материалом, выполнение химического опыта, выполнение письменной самостоятельная работы).
- Частично-поисковый (эвристический) метод (словесные: беседа-дискуссия; словесно-наглядные: дискуссия с демонстрацией средств наглядности, самостоятельная работа учащихся с наглядным пособием; словесно-наглядно-практические: работа учащихся с раздаточным материалом, выполнение химического опыта, выполнение письменной самостоятельная работы).
- Исследовательский метод (словесно-наглядно-практический: выполнение исследовательского химического опыта).
Формы организации деятельности: фронтальная, групповая (парная).
I. Организационный этап.
- Приветствие.
- Определение отсутствующих.
- Проверка готовности к уроку.
Наличие дневника, классной тетрадки, учебника по химии, ручки.
II. Подготовка учащихся к активному и сознательному усвоению нового материала.
Учитель: Для того чтобы определить тему сегодняшнего урока нам с вами необходимо разгадать ребус?
Слайд 1
Разгадайте ребус и мы узнаем тему сегодняшнего урока.

Рис. 1
(КИСТИ) КИ + (СЛОН) СЛО + РОД
КИСЛОРОД
Учитель: Тема сегодняшнего урока: “Кислород, его общая характеристика и нахождение в природе. Физические свойства кислорода. Получение”.
Слайд 2
Тема сегодняшнего урока: “Кислород, его общая характеристика и нахождение в природе. Физические свойства кислорода. Получение”.
Слайд 3
“Кислород” – это вещество, вокруг которого вращается земная химия.
Я. Берцелиус
Учитель: С помощью языка химии необходимо на доске записать: кислород как химический элемент и как простое вещество.
Кислород – как элемент – О .
Кислород – как простое вещество – О2.
Учитель: Сейчас на экране появится несколько фраз (изречений), вам нужно определить в каком значении упоминается в них кислород – как химический элемент или как простое вещество.
Слайд 4
Задание: Определите кислород как химический элемент или простое вещество.
- Кислород входит в состав жизненно важных органических веществ: белков, жиров, углеводов.
- Все живые вещества на Земле дышат кислородом.
- В состав ржавчины входят железо и кислород.
- Рыбы дышат кислородом, растворенным в воде.
- При фотосинтезе зеленые растения выделяют кислород.
Учитель: Вам необходимо с помощью ПСХЭ им. Д.И.Менделеева дать характеристику химическому элементу “Кислород”, по следующему плану:
Слайд 5:
- Порядковый номер –
- Относительная атомная масса –
- Период –
- Группа –
- Подгруппа –
- Валентность –
Учитель: Проверим, внимание на экран
Слайд 6
- Порядковый номер – 8
- Относительная атомная масса – Ar(О) = 16
- Период – второй
- Группа – VI
- Подгруппа – а (главная)
- Валентность – II
Слайд 7
Распространение кислорода в природе:
Первое место по распространенности в земной коре, т.е. литосфере, занимает кислород – 49%, далее следуют кремний – 26%, алюминий – 7%, железо – 5%, кальций – 4%, натрий – 2%, калий – 2%, магний – 2%, водород – 1%.
В биосфере около 65% от массы живых организмов приходится на кислород.
В гидросфере на его долю приходится 89%.
В атмосфере: 23% по массе, 21% по объему.
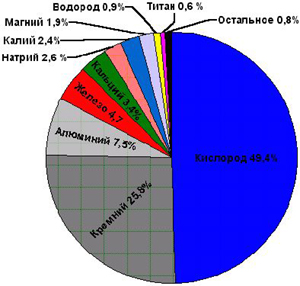
Рис. 2
Учитель: Вам необходимо с помощью ПСХЭ им. Д.И.Менделеева дать характеристику простому веществу “Кислород”.
Итак, какова же химическая формула простого вещества – 02
Относительная молекулярная масса Мг(02) = 32
Слайд 8
История открытия кислорода.
 Рис. 3
Рис 5 |
 Рис. 4
Рис. 6 |
Учитель комментирует: В 1750 году М.В. Ломоносов провел опыты и доказал, что в состав воздуха входит вещество, окисляющее металл. Он назвал его флогистоном.
Получил кислород в 1771 году Карл Шееле. Независимо от него кислород был получен Дж. Пристли в 1774 году.
А история простая…
Джозеф Пристли как-то раз,
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета , без названья,
Ярче в нем горит свеча.
А не вреден для дыханья?
Не узнаешь у врача!
Новый газ из колбы вышел –
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит…
В 1775 году А. Лавуазье установил, что кислород – составная часть воздуха и содержится во многих веществах.
Из атомов мир создавала природа:
Два атома легких взяла водорода,
Прибавила атом один кислорода –
И получилась частица воды,
Море воды, океаны и льды…
Стал кислород
Чуть не всюду начинкой.
С кремнием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.
И на Земле появились растения.
Жизнь появилась:
Дыханье, горенье…
Первые птицы и первые звери,
Первые люди, что жили в пещере…
Огонь добывали при помощи трения,
Хотя и не знали причины горения.
Роль кислорода на нашей Земле
Понял великий Лавуазье.
Учитель: Теперь познакомимся с кислородом на опыте. Так как мы будем использовать нагревательный прибор (спиртовку), необходимо вспомнить ТБ при работе со спиртовкой:
- Пользуясь спиртовкой, нельзя ее зажигать от другой спиртовки, так как может пролиться спирт и возникнет пожар.
- Чтобы погасить пламя спиртовки, ее следует закрыть колпачком.
Налейте в химический стакан раствор Н2О2 (пероксида водорода).
Зажгите спиртовку, поднесите лучину в пламя и затушите лучину. Потом добавьте оксид марганца (IV) в химический стакан и поднесите тлеющую лучину к стакану – что наблюдается?
Ученик: Лучина – вспыхивает. Таким способом мы определили, что в химическом стакане находится кислород.
Учитель: В данном опыте оксид марганца (IV) является катализатором – веществом, которое ускоряет процесс химической реакции, но сам при этом не расходуется.
Демонстрационный эксперимент: “Получение кислорода из перманганата калия”.
Собираем прибор.
Собираем кислород методом вытеснения воздуха в коническую колбу, через некоторое время проверяем на наличие кислорода, с помощью тлеющей лучины, если она вспыхивает, то кислорода собрано достаточное количество.
Закрываем резиновой пробкой и выставляем на подъемный столик.
И предлагаем учащимся охарактеризовать физические свойства кислорода по следующим критериям.
Слайд 9
- Агрегатное состояние -...
- Цвет – ...
- Запах – ...
- Растворимость в воде – ...
- t o кип. –...
- Электропроводность – ...
- Теплопроводность – ...
- Тяжелее или легче воздуха
Учитель: Проверим, внимание на экран.
Слайд 10
- Агрегатное состояние – газ.
- Цвет – без цвета
- Запах – без запаха
- Растворимость в воде – плохо растворим
- t° кип. – 183°С
- Электропроводность – неэлектропроводен
- Теплопроводность – плохо проводит тепло (плохая)
- Тяжелее воздуха
Учитель: Ставим перед учащимися проблемный вопрос: Почему на картинке кислород в виде жидкости голубого цвета?
Слайд 11

Рис. 7
Ответ учащихся (дополняет учитель): Этот кислород в сжиженном состоянии, а жидкий кислород голубого цвета.
Теперь давайте обобщим и запишем в тетрадь разные способы получения кислорода, которые мы сегодня с вами наблюдали.
Слайд 12
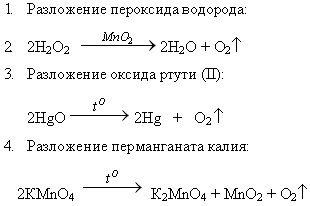
Способы получения кислорода: I. Лабораторные способы:
1. Разложение пероксида водорода:
![]()
2. Разложение оксида ртути (II):
![]()
3. Разложение перманганата калия:
![]()
Задание для учащихся: расставьте коэффициенты в данных уравнениях реакций.
Учитель: Проверим, внимание на экран.
Слайд 13
Учитель: Вопрос для учащихся: из какого вещества еще можно получить кислород?
Ученик: Электролиз воды
![]()
Записываем в тетрадь определение:
Электролиз – действие постоянного электрического тока.
Слайд 14
А теперь обобщаем способы собирания кислорода, которые вы сегодня видели на уроке.
|
|
|
| Собирание кислорода методом вытеснения воды | Собирание кислорода методом вытеснения воздуха |
Учитель: В завершении урока, проверим свои знания.
Написание теста: Приложение 1



