Тип урока: Изучение нового материала и приобретение новых умений
Цели урока: ученики должны научиться видеть структурные отличия альдегидов и кетонов, должны усвоить электронное строение карбонильной группы, влияние углеводородных радикалов на реакционную способность альдегидов и кетонов, разбираться в механизме реакции нуклеофильного присоединения.
Задачи урока:
Познавательные:
- Продолжить закрепление следующих понятий: функциональная группа, водородная связь
- Обеспечить в ходе урока усвоение нового элемента структуры – электронного строения карбонильной группы >С=0
- Продолжить формировать следующие специальные навыки: определение электронной природы двойной связи непредельных углеводородов, понятия гомолог, изомер на примерах карбонильных соединений.
Мировоззренческие:
- Подчеркнуть взаимосвязь строения веществ и внешних его свойств, как пример проявления одного из признаков метода диалектического познания явлений
Развивающие:
- Продолжить работу по формированию умений делать выводы, а также общие выводы из единичных явлений
- Сформировать элементы творческого поиска на основе приема обобщения
Оборудование урока:
- Шаростержневая модель молекулы ацетальдегида
- Таблица “Схема особенности строения карбонильных соединений”
- Карточка с пояснением урока на каждую парту.
Диагностика учений и навыков учащихся
Учащиеся умеют составлять структурные формулы спиртов, обозначать распределение электронной плотности в их молекулах, разъяснять смысл структурных и электронных формул. Ребятами качественно усвоен материал о порядке соединения атомов в молекуле, видах изомерии, о гомологах. У учеников сформировано понятие о взаимном влиянии атомов в молекуле: влияние кислородного атома на подвижность атома водорода в функциональной группе спиртов; взаимное влияние гидроксильных групп в молекуле многоатомных спиртов, взаимодействие функциональной группы-ОН и фенильного радикала.
Ребята разбираются в полном объеме в понятии водородная связь на примере спиртов.
Структура урока:
- Оргмомент – 1 мин.
- Диагностика знаний и умений – 12 мин.
- Работа над новым материалом – 17 мин.
- Проверка усвоения – 4 мин.
- Подведение итога урока и оценка знаний – 3 мин.
- Инструктаж по домашнему заданию – 3 мин.
- Резервное время –
Форма урока: фронтальная, парная, творческая.
Ход урока
I. Оргмомент
Урок начинается с взаимного приветствия. Настраиваю ребят на серьезную, вдумчивую работу в доброжелательной обстановке, проверяю посадку.
II. Диагностика умений и знаний учащихся.
1. Проверка домашней работы.
- Решение задачи с подробным ее объяснением.
Задача: соединение неизвестного строения медленно реагирует с натрием, неокисляется раствором дихромата натрия, с концентрированной соляной кислотой реагирует быстро с образованием алкилхлора, содержащего 33,3% хлора по массе. Определите строение этого соединения.
Вызываю к доске ученика.
Вариант его решения: характер реакций показывает, что в реакцию вступают предельный спирт, предельного характера: R-OH+ HCl -> RCl+H2O
Пусть в реакции образовалась 100г. Вещества RCl.
t(э) = t (вещества) · W (э)
t (Cl) = 100г. · 0,333 = 33,3
V = ![]() ; V =
; V = ![]() ; V(CnH2n+1) =
; V(CnH2n+1) = ![]()
R – это свободный углеводородный радикал CnH2n+1
Исходя из строения молекулы RCl: V(Cl) / V(R) = 1 / 1.
![]() ; M(CnH2n+1) = 71 г/моль; n = 5 > C5H11OH.
; M(CnH2n+1) = 71 г/моль; n = 5 > C5H11OH.
Ответ: это вещество бутиловый спирт.
В результате анализа решения задачи выясняю, что большинство ребят считают, что задача не имеет окончательного решения, т.к. указана молекулярная формула спирта, а не его строение.
Вызываю к доске ученика. Он обращает внимание на условие задачи, где указывается условия течения реакций, правильно делается вывод о том, что если спирт медленно реагирует с натрием, то у него слабо выражены кислотные свойства, за счет увеличения V на атоме кислорода, вызванного +J эффектом радикалов, в тоже время быстрое образование алкилхлорида с концентрированной соляной кислотой указывает на основные свойства спирта, ярче всего проявляющиеся у третичных спиртов. Т что это третичный спирт указывает также его неспособность окисляться дихроматом натрия из-за отсутствия водорода при атоме углерода, связанного с функциональной группой. Заключение ответа – это третичный спирт.
Разбить четыре атома углерода на три радикала можно единственным способом
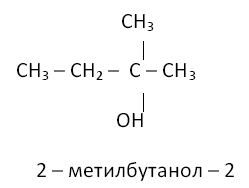
Прошу ученика связать, сказанное им с одним из основных положений теории строения А.М. Бутлерова.
Звучит правильный ответ: строение молекул может быть установлено на основе изучения их химических свойств и наоборот. Таким образом мы и подошли к одной из задач урока: увидеть взаимосвязь строения вещества и внешних его свойств
- Вызываю ученика для решения проблемы, которая была поставлена в домашней работе: Какие формулы молекул спиртов можно вывести из пропилена? Какие из этих спиртов не существуют в свободном виде? Сначала учащийся составляет схему возможных спиртов:
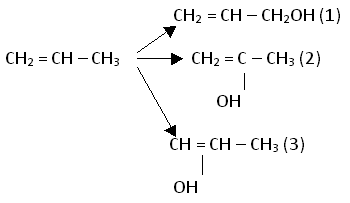
Затем определяет возможность их существования. Из трех спиртов существует в свободном виде только аллиловый спирт (1) – у него спиртовая группа не находится у атома углерода, образующего двойную связь. Спирт (2) превращается в соединения состава.
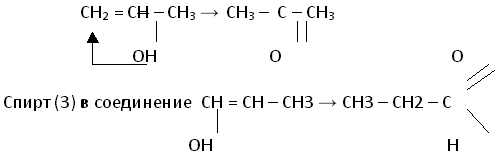
Учащийся использовал правило Эльтекова и его электронную трактовку.
- Обращаюсь к классу, прошу вспомнить тему “Спирты” и выделить самое главное в этой теме.
Учащиеся правильно находят ответ на вопрос:
- Впервые введено понятие функциональной группы;
- Рассмотрено влияние углеводородных радикалов на течение химических реакций;
- Познакомились с видом межмолекулярной связи – водородной связью
III. Работа над новым материалом.
- Сообщение цели урока.
- Работа по карточкам
Коротко подвожу итог проверки домашнего задания. Хвалю ребят. Отмечаю, что все вопросы к ребятам были сформулированы таким образом, что бы ответы на них отражали цель и задачи урока сегодня. Ставлю перед ребятами цель урока.
Прошу записать тему урока, затем посмотреть на карточки, дать определение альдегидам, кетонам и выделить функциональную карбонильную группу. Ответить на вопросы, ребята работают в паре, где более сильный ученик помогает разобраться в материале более слабому. Обсуждаем задание.
Основные понятия:
- Указано наличие b – и – П – связи;
- Атом углерода в карбонильной группе Sp2 – гибридизирован (могут быть ответы, что атом углерода Sp3 – гибридизирован, указываем на ошибку);
- Объяснено образование П – связи за счет бокового перекрывания электронных облаков внешних электронов р – подуровня атомов углерода и кислорода;
- Отмечено отличие двойной связи в молекуле альдегида или кетона от двойной связи в молекуле этилена (установлена между атомами с разной электроотрицательностью);
- Обозначено распределение электронной плотности П – связи указан частично положительный на атоме углерода и частично отрицательный на атоме кислорода заряда.
Подвожу итог.
- Изучение номенклатуры, изомерии.
- Физические свойства
- Возможное течение химических реакций карбонильных соединений.
- Различие в химических свойствах альдегидов и кетонов.
Название альдегидов – название предельного углеводорода + аль.
Название кетонов – название предельного углеводорода + он
Прошу назвать предложенные на карточках вещества.
Выслушиваю варианты ответов:
Ученик III уровня развития 2 – метил – 3 этилбутаналь – 1
Ученик II уровня развития 2,3 диметилпентаналь
Ученик III уровня развития 2 – метилпентанон – 4
Ученик I и II уровня развития 4 – метилпентанон – 2
Ученик II уровня объясняет, в чем произошла ошибка в названиях, данных учеником III уровня развития.
Предлагаю ребятам предсказать за счет чего, будет существовать изомерия альдегидов и кетонов.
Ответы: альдегиды – изомерия углеродной цепочки и функциональной группы;
Кетон – изомерия углеродной цепочки, функциональной группы
Ученик I уровня развития указывает на невозможность существования у альдегидов изомерии функциональной группы. Никто не указал межклассовую изомерию, наводящими вопросами класс устанавливает, что альдегиды изомерны кетонам.
Ознакомление с физическими свойствами карбонильных соединений. Прошу ответить на вопросы, почему метеналь газ, а метаналь, этаналь, пропаналь – хорошо растворимы в воде. Ученик II уровня развития успешно справляются с первым вопросом, используя за основу ответа водородную связь: если метаналь – газ, значит между молекулами не существует водородная связь, а значит шаг заряд + b на атоме водорода.
Второй вопрос вызывает затруднение, ответ дает ученик I уровня развития: между водородом молекулы воды, а не альдегида и кислородом молекулы альдегида реально возникает водородная связь.
Прошу ребят выразить особенности карбонильных соединений схемой на карточках (работа групповая). Используя понятия электрофильные реакций, нуклеофильные реакции учащиеся справляются с прогнозированием течения реакций.
Прошу учащихся сравнить строение альдегидов и кетонов и отметить будет ли разница в строении веществ влиять на течение химических реакций. Ребята высказывают мнение, что наличие двух углеводородных радикалов у кетонов гасит +S на атоме углевода карбонильной группы, уменьшая активность кетонов по сравнению с альдегидами (в течение ответа задаю наводящие вопросы)
В конце беседы даю понятие реакций окисления для альдагидов и кетонов. Вполне логично, что если в альдегидной группе содержится водород по возможности реакции окисления. В результате сильной поляризации связи C = O на углеродном атоме значительно понижается электронная плотность. Стремясь ее компенсировать, карбонильный углерод притягивает электрон от соседнего углеродного атома и от собственного атома водорода. Последний приобретает подвижность, легко окисляется, отсутствие у кетонов водорода у карбонильной группы не позволяет их окислять слабыми окислителями, а сильнее разрушает молекулу.
IV. Проверка усвоения.
Для закрепления знаний о взаимном влиянии атомов в молекулах даю задание: сравнить активность соединений 2-хлорпропаналя и 3-хлорпропаналя. Ученик I уровня развития на структурных формулах альдегидов (они написаны учеником III уровня развития) показывает влияние атома хлора на активность соединений (-J).
После анализа ответа даю второе задание: сравнить активность: пропаналь, 2-матилпропаналь, 2,2-диметилпропаналь. Ученик II уровня развития способен дать ответ, на основе структурных формул (написанных учеником III уровня развития) правильно делается вывод о погашении S+ углерода карбонильного атома в альдегидах разветвленного строения
V. Итог урока, оценка знаний
Вопросно-ответная форма беседы.
- Что нового для себя открыли на уроке
- Что дополнило ваши знания по теме “Кислородосодержащиеся органические соединения”
VI. Постановка домашнего задания.
Выполнить оставшиеся задания на карточках, работа выполняется аналогично той, что была в классе.
БЛАГОДАРЮ ВСЕХ ЗА УРОК!