Тип: урок изучения нового материала.
Вид: урок-исследование.
Оборудование: интерактивная доска (мультимедийный проектор).
Цель урока: исследование класса "Оксиды" как одного из важнейших представителей основных классов неорганических соединений.
Инструкция по проведению урока:
Содержание урока реализуется через использование тематической мультимедийной презентации "Исследование класса "Оксиды" - Приложение №1. Результаты исследования учащиеся заносят в специально разработанную технологическую карту - ТК - Приложение №2.(впоследствии ТК вкладывается или подклеивается к рабочей тетради учащегося - формирование индивидуального банка опорных материалов).
***в скобках приведены возможные правильные варианты ответов учащихся.
Ход урока
Презентация "Исследование класса "Оксиды".
Слайд №1 "Исследование класса "Оксиды".
Учитель: Ребята! Сегодня нам предстоит исследовать один из важнейших классов неорганических соединений. Для работы используем следующий план исследования:
Слайд №2
- Определение.
- Классификация.
- Номенклатура.
- Физические свойства.
- Химические свойства.
- Получение.
- Применение.
Учитель: Изучая тему "Кислород. Оксиды. Горение" вы уже познакомились с составом и определением данного класса. Давайте вспомним его название.
Слайд №3
С кислородом ходит парой,
То металл, то неметалл он,
Дружбу связями скрепит
Всем известный класс - : (оксид).
Учитель: соотнесите данное стихотворение с уже известным вам определением оксидов (Оксиды - это сложные вещества, которые состоят из двух элементов, одним из которых является кислород). Запишите определение в ваши ТК - шаг №1.
Слайд №4
Слайд - "ключ"
Оксиды - это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Учитель: в ТК (шаг №2) в предложенном перечне веществ выберите формулы веществ, относящиеся к оксидам. Обведите их в овал. Проверим результаты вашего поиска (устно).
Теперь сравните свой выбор по ключу.
Слайд №5
Относятся к оксидам:
MgO, H2O, Na2O, CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe2O3.
Учитель: Сравните состав данных оксидов. Назовите сходные признаки (сложные вещества, состоят из двух элементов, в формулу каждого оксида входит химический элемент кислород). Выделите различия в составе данных оксидов (в некоторых оксидах атом кислорода связан с атомами металлов, например - K2O, Fe2O3; имеются оксиды, в которых атом кислорода связан с атомами неметаллов - H2O, SO2). Подчеркните оксиды металлов одной чертой, оксиды неметаллов - двумя чертами. Опираясь на результаты исследования, предложите возможный вариант классификации оксидов с примерами - шаг №3 по ТК - заполните прямоугольные окошки. Проверим по слайд - "ключу".
Слайд №6 Слайд - "ключ"
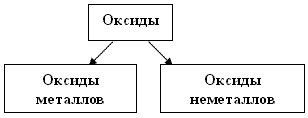
Учитель: Многие оксиды взаимодействуют с водой. При этом оксиды активных металлов образуют растворимые основания - щелочи, а большинство оксидов неметаллов взаимодействуют с водой с образованием кислоты. По данному признаку оксиды классифицируют на основные и кислотные. Дополните схему классификации оксидов в ТК по шагу №3 - заполните овальные окошечки.
Слайд №7
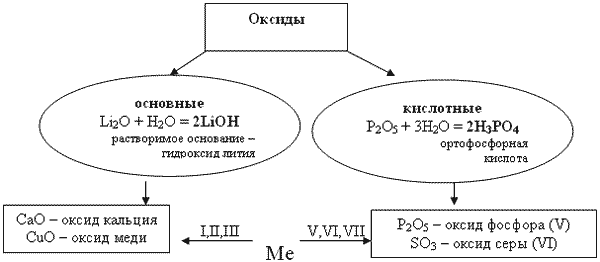
Учитель: Ребята! Обратите внимание и запомните: неметаллы образуют только кислотные оксиды. Металлы с валентностью меньше четырех, преимущественно образуют основные оксиды: MnO - оксиду марганца (II) соответствует основание Mn(OH)2. Металлы с валентностью больше четырех - кислотные оксиды: Mn2O7 - оксиду марганца (VII) соответствует кислота HMnO4. Внесите это в свои ТК. А запомнить это правило вам помогут четверостишия:
Слайд №8
Неметаллы, знай, мой друг,
Строго все себя ведут:
Коль в оксиды он подался -
Так "кислотным" и назвался!Металл хотел запутать нас,
Но я найду опору:
Валентность меньше четырех -
Оксид зову "основным".Ну а уж если повезло,
Валентность пять и выше -
Я буду помнить, всем назло,
Оксид "кислотным" кличут.
Учитель: переходим к следующему этапу - исследование номенклатуры оксидов. Названия веществ, относящихся к данному классу, следует начинать со слова "оксид:" с добавлением названия второго химического элемента, входящего в данный оксид. Так, в нашем перечне выделенных оксидов первые три вещества будут иметь следующие названия:
Слайд №9
MgO - оксид магния, H2O - оксид водорода, Na2O - оксид натрия.
Учитель: по ТК, пользуясь шагом №2, дайте названия всем выделенным оксидам (устная работа).
Слайд №10
CO2, FeO, CO, SO3, N2O5, K2O, SO2, CaO, Fe2O3
Учитель: какие трудности или вопросы возникли у вас при определении названий для каждого оксида? (для некоторых пар оксидов соответствую одинаковые названия: CO2 и CO - оксиды углерода). Запомните: в подобных случаях вы действительно встречаетесь с оксидом одного и того же химического элемента, но в разных его валентных состояниях. Для "разведения" названий для каждого из веществ необходимо в конце указать валентность этого химического элемента. Названия оксидов, в составе которых имеются химические элементы с постоянной валентностью, даются без упоминания о валентности.
Слайд №11
II
CO - оксид углерода (II)
IV
CO2 - оксид углерода (IV)
Учитель: по ТК, шаг №4, назовите другие пары оксидов, образованные элементами с переменной валентностью (FeO - оксид железа (II), Fe2O3 - оксид железа (III), SO2 - оксид серы (IV), SO3 - оксид серы (VI)).
Следующий этап нашего совместного исследования - шаг №5 по ТК - физические свойства оксидов. Все физические свойства оксидов зашифрованы в данном стихотворении.
Слайд №12
Широка натура у оксидов,
Камнем вниз, а то рекой течет,
А захочет - газ различных видов,
И веществ создаст круговорот.Может черным быть, и белым,
Может с запахом и без,
Не оставит вас без дела:
"Изучайте - мир чудес!"
Пользуясь материалом учебника, попытайтесь определить эти свойства (оксиды могут быть твердыми, жидкими и газообразными веществами, различной окраски, с запахом и без запаха, тяжелее или легче окружающего воздуха). На места пропусков вставьте соответствующие формулы оксидов. Проверьте по слайд - "ключу".
Слайд №13. Слайд - "ключ"
Широка натура у оксидов,
Камнем вниз (CuO, CaO), а то рекой течет (H2O),
А захочет - газ различных видов (CO2, SO2),
И веществ создаст круговорот (CO2, H2O, SO3) .Может черным быть (CuO), и белым (CaO),
Может с запахом (SO2) и без (CO2),
Не оставит вас без дела:
"Изучайте - мир чудес!"
Учитель: переходим к исследованию химических свойств оксидов (ссылка на слайд №13). С некоторыми из них вы уже знакомы, например, возможность некоторых оксидов взаимодействовать с водой с образованием соответствующих растворимых оснований или кислот. Кроме того, оксиды могут взаимодействовать друг с другом - в итоге образуется соль. Кислотные оксиды легко вступают во взаимодействие с растворимыми основаниями, а основные оксиды - с кислотами, в результате этих реакций образуются соответствующие соли и вода. Внесите в ТК уравнения реакций, характеризующих химические свойства оксидов - шаг №6.
Слайд №14
| Химические свойства оксидов | |
| основных | кислотных |
| Основные оксиды взаимодействуют с
кислотами, получаются соль и вода: CuO + H2SO4 = CuSO4 + H2O Оксиды активных металлов взаимодействуют с водой с образованием растворимых оснований - щелочей: LiO + H2O = 2LiOH |
Кислотные оксиды взаимодействуют с
растворимыми основаниями, получаются соль и
вода: СO2 + Ca(OH)2 = CaCO3 + H2O Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты: P2O5 + 3H2O = 2H3PO4 |
| Основные и кислотные оксиды взаимодействуют между собой с образованием соли: CaO + H2O = CaCO3 | |
| Менее летучие кислотные оксиды
вытесняют более летучие из их солей: CaCO3 + SiO2 = CaSiO3 + CO2 |
|
Учитель: Получают оксиды двумя основными способами (ссылка на слайд №14). Первый способ: разложение, как правило, под воздействием температуры, сложных кислородсодержащих веществ - нерастворимых оснований, кислот и солей. Со вторым способом вы уже знакомы - это горение простых и сложных веществ. Запишите по одному примеру в ТК, шаг № 7.
Слайды №15, 16
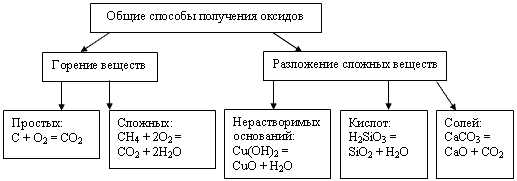
Учитель: закончим исследование класса "Оксиды" изучением вопросов, связанных с их применением. Значение оксидов в промышленности и в быту, а также для природных процессов велико. Вы уже знакомились со значением и применением воды - H2O (оксид водорода). Многие оксиды входят в состав руд, из которых в дальнейшем получают чугун и сталь - оксиды железа Fe2O3 и Fe3O4. Оксид кальция СaO или негашеная известь используется для получения гашеной извести - Ca(OH)2, которая используется в производстве строительных материалов, также как и оксид кремния (IV) - SiO2. Оксид углерода (IV) CO2 - применяется в пищевой промышленности для производства газированных напитков. Пользуясь материалами слайда заполните шаг №8 в ваших ТК.
Слайд №17
Основные области применения оксидов:
В промышленности: Fe2O3 и Fe3O4 - производство чугуна и стали, СaO и SiO2 - производство строительных материалов, CO2 - в пищевой промышленности для производства газированных напитков, H2O - в производственных охладительных системах, для получения новых веществ, в системах орошения, в качестве растворителя и т.д.
В быту: H2O - в питьевых и хозяйственных целях, SiO2 - входит в состав чистящих веществ, ZnO - входит в состав белой краски.
В природных процессах: H2O и CO2 - обеспечивают осуществление процесса фотосинтеза, H2O - естественный растворитель, составляет основную часть цитоплазмы животных и растительных клеток и т.д.
Учитель: наше исследование класса "Оксиды" согласно предложенному плану закончено. Д/з - (можно вынести на слайд №18) по ТК составить устный рассказ "Общая характеристика класса "Оксиды". Письменное задание: предложить химические реакции, при помощи которых можно осуществить следующие превращение (выполнить две цепочки на выбор учащегося):
а) K---K2O---KOH---K2CO3
б) S---S2O3---H2SO4---CaSO4
в) Al(OH)3---Al2O3
г) MgCO3---MgO---MgCO3
Источники информации для подготовки урока:
- Программа курса химии для 8-9 классов общеобразовательных учреждений/автор Н.Н.Гара/М.: Просвещение, 2008;
- Г.Е.Рудзитис и Ф.Г.Фельдман/Химия - 8 класс, учебник/ М.: Просвещение, 2008;
- В ходе урока использованы химические стихи автора урока - Москаленко Н.Н.