Цели:
Оборудование: образцы оксидов: вода, углекислый газ, оксид меди (II), оксид кальция, оксид кремния (IV) , оксид фосфора (V), оксид железа (III), универсальный индикатор , пробирки.
ХОД УРОКА
1. Организационный момент.
2. Начать урок я хочу с загадки :
Хоть составчик мой и сложный,
Без меня жить не возможно,
Я - отличный растворитель,
Жажды лучший утолитель.
А разрушите, так сразу
Два получите вы газа.
Ученики : Это вода.
Учитель : Как еще можно назвать это вещество?
Ученики: Оксид водорода .
Учитель : Итак, тема урока "Номенклатура и классификация оксидов". (в ходе беседы по предложенным ниже вопросам актуализируются ранее полученные знания.)
- Какие вещества называют оксидами?
- Каков порядок составления формул оксидов ?
- Каков порядок составления названия оксидов ?
- По каким признакам можно распознать оксиды среди других веществ?
Задание . Среди перечисленных веществ выбрать оксиды: NН3 , СН4 , NO , Р2О5 , Mg3N2 , КН, НСl ,СаО, CrO3. Назовите выбранные вещества.
А теперь выполним лабораторный опыт № 1 (стр. 114 учебника Кузнецова Н.Е. , Титова И.М. Гара Н.Н., Жегин А.Ю. "Химия 8"). По результатам наблюдения и используя справочную литературу заполните таблицу:
Название оксида |
Формула |
Агрегатное состояние (н.у.) |
Цвет |
Температура плавления |
Температура кипения |
Растворимость в воде |
Уравнение получения этого оксида |
Вода |
|||||||
Углекис-лый газ |
|||||||
Оксид меди (II) |
|||||||
Оксид кальция |
|||||||
Оксид кремния (IV) |
-Итак, по каким физическим признакам отличаются оксиды друг от друга?(Агрегатное состояние, цвет, температура плавления и кипения)
Выполним лабораторный опыт № 2 (стр. 114 учебника Кузнецова Н.Е., Титова И.М.
Гара Н.Н., Жегин А.Ю. "Химия 8"). Что наблюдаем в каждом случае? Объясните наблюдения.
Опыт №2 позволяет сделать вывод о том , что оксиды отличаются не только по физическим, но и по химическим свойствам.
Различают четыре основные группы оксидов : основные, кислотные, амфотерные и безразличные. Как видно из приведенных в схеме общих формул, основные оксиды могут быть образованы металлами (Me), проявляющими валентность I и II .К кислотным относятся почти все оксиды, в состав которых входят помимо кислорода атомы неметаллов (Нм), а также оксиды металлов, проявляющих валентность более четырех: (V205, Cr03, Мп207 и др.).
Некоторые металлы с валентностью II и III образуют с кислородом особую группу соединений, отличающихся от прочих особенностями химических свойств и называющихся амфотерными оксидами. (BeO, Z nO , А1203, Сг2Оэ) К безразличным оксидам относят воду Н2О и угарный газ СО. Обратим свое внимание на кислотные и основные оксиды.
Многие кислоты и основания можно получить путем растворения соответствующих оксидов в воде.
Растворение оксидов в воде - химический процесс, сопровождающийся образованием новых
Химических соединений :
а) С02 + Н20 = Н2СО3 a) Na20 + Н20 =2NaOH
б) Р205 + 3 Н2О = Н3РО4 б)ВаО +Н20 = Ва(ОН)2
Большей части кислотных оксидов соответствуют кислоты, а практически всем основным оксидам - основания. Но большинство основных оксидов нерастворимы , исключением являются лишь оксиды, соответствующие элементам первой и второй групп периодической системы (кроме ВеО и МgО): Li2 О , Na2 О , K2 О, Ca О , Ba О.
Большинство же кислотных оксидов растворимы в воде (исключение - SiО2 ).
Кислоты и основания называют гидроксидами (это слово состоит из двух корней гидро -"вода" + оксид).
Учитель , с целью закрепления нового материала предлагает учащимся выполнить следующие задания
1. Найдите в каждом ряду один оксид, не соответствующий следуюим признакам:
| 1) Кислотный оксид среди основных | а) Na20, S02 BaO, К20 |
| 2) Основной оксид среди кислотных | б)N02, CuO, FeO.CaO |
| 3) Основной оксид среди | В) S02, C02, CaO, Cr03 |
| Г) A1203, Na20, ZnO, Cr203 |
2. Игра в "Крестики и нолики". Выигрышный путь составляют: а) оксиды, взаимодействующие с водой; б) окрашенные оксиды.
А)
| MnO | ZnO | CaO | Fe2O3 | CaO | Al2O3 | |
| SO3 | SO2 | Al2O3 | ZnO | Ag2O | CO2 | |
| Na2O | Ag2O | CuO | SO3 | BaO | K2O |
Б)
| CuO | SO3 | CO | SO3 | Al2O3 | CO | |
| SO2 | NO2 | CO2 | Сr2O3 | FeO | NO2 | |
| Сr2O3 | NO | Fe2O3 | NO | CO2 | CuO |
3. Составьте формулы всех возможных оксидов, комбинируя нижеприведенные составные части по горизонтали (слева направо) и вертикали (сверху вниз) при условии, что оксидообразующие составные части должны стоять рядом. Сумма всех оксидов равняется относительной атомной массе углерода.
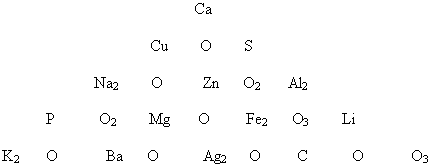
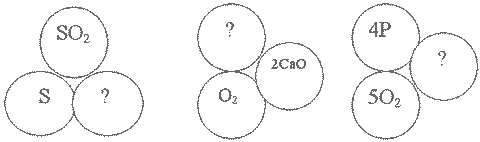
4. Впишите отсутствующую формулу вещества (с необходимыми индексами и коэффициентами)
Учитель анализирует и оценивает работу ребят, подводит итог урока.
Домашнее задание параграф 35 , составить презентацию по теме " Применение оксидов".