Цель:
- Ознакомление учащихся со свойствами воды на уровне растворителя, выработка навыков по применению растворов в быту и в жизнедеятельности человека.
Задачи:
- Актуализировать сведения учащихся о растворах,
- Сформировать представление о растворимости и концентрации растворов,
- На практических примерах научить решать задачи на определение концентрации растворов.
- Развивать логическое мышление, умение анализировать наблюдения.
Оборудование:
- спиртовки,
- пробирки,
- химические стаканы на 50 мл,
- стеклянные палочки,
- штатив для пробирок
Реактивы:
- поваренная соль,
- нитрат калия,
- сахар,
- вода
“Воде была дана волшебная власть стать соком жизни на Земле.”
( Леонардо да Винчи)
I . Урок начинается со слов В.И. Вернадского “…она стоит особняком в истории нашей планеты… Нет земного вещества- минерала, горной породы, живого тела, которое ее не заключало бы.
Все земное вещество ею проникнуто и охвачено”
Учитель. О каком веществе идет речь? Мы с вами изучили свойство воды.
Повторение свойств воды-
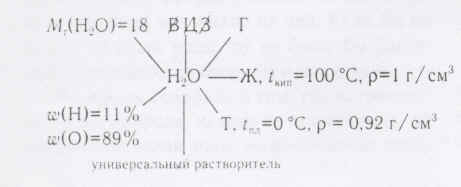
1. Физические свойства воды, агрегатное состояние
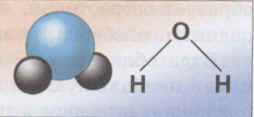
2. Строение молекулы воды.
(Молекула воды имеет угловое строение, что обуславливает рыхлость льда и жидкой воды и как следствие аномальную зависимость плотности от температуры. Именно поэтому крупные водоемы не промерзают до дна, что делает возможным существование в них жизни. Молекулы воды образуют водородные связи, которые создают пространственный каркас и тем самым определяют высокую теплоемкость. Теплоемкость воды равна 4, 2 Дж/г, что в 4 раза выше горных пород.)
Отгадать загадки о воде:
1. Не конь, а бежит.
Не лес, а шумит. ( Ручеек)
2. Посреди поля лежит зеркало: стекло голубое, рама зелена ( Пруд)
3. На дворе – горой,
А в избе - водой. ( Снег)
4. Меня часто просят, ждут.
А только покажусь, все прятаться бегут. ( Дождь)
5. Выросло, сповыросло,
Как борода повылезло.
Солнышко встало,
Ничего не стало. ( Сосулька )
6. Чист и ясен, как алмаз,
Дорог не бывает.
Он от матери рожден,
Сам ее рождает ( Лед)
По ходу урока дети заполняют карту для отчета
Карта отчета
| Вопросы | Ответы |
| Физические свойства воды: | |
| А. цвет, вкус, запах | |
| Б. плотность, Т пл., Т кип. | |
| Строение молекулы воды. | |
| Примеры веществ: | |
| А. растворимых, в воде | |
| Б. нерастворимых в воде | |
| Факторы ,влияющие на растворимость веществ в воде | |
| Чем определяется жесткость воды. | |
| Как ее можно устранить. | |
| Почему опасно для жизни повышенное содержание нитратов. | |
| Как можно устранить кислотность почв. |
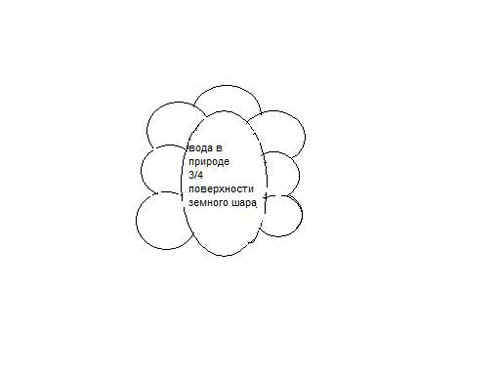
Выясняем роль воды в природе. Необходимо заполнить схему
Это интересно. ( Сообщения учащихся ) Наш организм состоит на 65 % из воды, если перевести проценты в литры то получиться , что в человеке массой 65 кг. Содержится 40 литров воды. Из них 25 л. Внутри клеток, 15 – в составе внеклеточных жидкостей. Мы выделяем 1,5 л слюны, 2,5 л желудочного сока, 0,7 сока поджелудочного и 3л кишечных соков.
Мозг человека содержит -81%, Почва -20 %,
Вода –это распределитель солнечной энергии на земле, главнейший творец климата, аккумулятор тепла .Рисунок 1
II. Вода- универсальный растворитель. Она растворяет многие газообразные (демонстрируем- минеральную газированную воду), жидкие (уксусная кислота), твердые (сахар) вещества. Но разве все растворы нам полезны. Так ,дождевая вода, растворяя содержащиеся в воздухе оксиды серы (II), углерода, азота, выпадает в виде кислотных дождей.
Обсуждение отрывка из произведения Ю. Томилина “Карусель над городом”
“На вид это была обыкновенная речка. Еще недавно в ней водились окуни и щуки и даже раки, которые любят чистую воду. Но несколько лет назад фабрика игрушек начисто перевела в ней всякую живность. Дольше все продержалась старая щука, но и она не выдержала. Переплыла в другой водоем, а там погибла от тоски и одиночества, но у этой щуки была красная голова, зеленое брюхо, синий хвост, и другие щуки с ней разговаривать не хотели.”
Затем, используя сообщения учащихся о заливе Кара-Богаз-Гол (Каспийской море и о Мертвом море (Израиль) ,обсуждаем причины, связанные с изменением растворимости солей в воде. Выясняем, почему вода бывает разного цвета и чем это может быть обусловлено.
Учащиеся проводят исследование воды: из- под крана в столовой, в кабинете химии и из колонок по улицам поселка. Выясняют, почему она имеет разный цвет.
Инструктаж по технике безопасности.
(Учитель демонстрирует окраску воды, обусловленную содержанием в ней ионов железа, меди, никеля.)
Но поскольку вода содержит соли, определяющие не только ее цвет, но и жесткость, проводят исследование воды на жесткость.
Воросы:
- Что такое жесткость воды?
- Какими последствиями чревато употребление жесткой воды?
- Как жесткость воды влияет на процесс приготовления пищи?
- Как можно устранить жесткость воды?
Инструкция по проведению опыта по определению жесткости воды
Жесткость воды определяется соединениями кальция и магния. Она бывает временная и постоянная.
Жесткая вода имеет ряд отрицательных качеств –при стирке часть мыла оседает на ткань, ткань становится грубой, ухудшается влаго- и воздухопроницаемость . Цвет ткани бледнеет, белая становится серой, снижается прочность . Она не используется в паровых котлах, в чайниках, так как образует на стенках посуды накипи. В жесткой воде с трудом варятся овощи, заваренный чай меняет вкус. У человека избыток солей кальция и магния вызывает почечно-каменные заболевания.
Определение временной жесткости воды. К 10 мл. исследуемой воды добавить 1-2 капли индикатора метилоранж. Титровать 0, 05 н. раствором соляной кислоты при перемешивании до перехода желтой окраски в розовую.
Определение постоянной жесткости воды. К 10 мл исследуемой воды добавить 6 капель аммиачного буфера и мерник индикатора Эрихрома черного Т. Провести титрование раствором триолона Б до перехода окраски от вино- красной до ярко голубого цвета .
По ходу исследования заполняется таблица “ Показатели качества исследуемой воды.”
Номер пробы |
|
Соли |
Химические свойства воды.
Учитель демонстрирует опыт “ Растворение йода в воде и спирте”.
Учащиеся делают вывод о зависимости растворимости от природы реагирующих веществ, температуры, давлении)
Учащиеся выполняют практическую работу “Растворимость нитрата калия ( калийной селитры) при нагревании”
Алгоритм выполнения работы:
- Налить в пробирку воды до 1/4 ее объема.
- Насыпать в пробирку нитрат калия, перемешивая соль, наблюдать процесс растворения.
- Когда соль больше не станет растворяться, нагреть пробирку.
(Инструкция по ТБ. Работа с нагревательными приборами.)
- Описываем наблюдения, зависимость растворения соли от температуры.
Учитель. А теперь построим график зависимости растворения веществ от температуры.
“ Растворимость калийной селитры в воде от температуры”
Т 0С |
Растворение г/л |
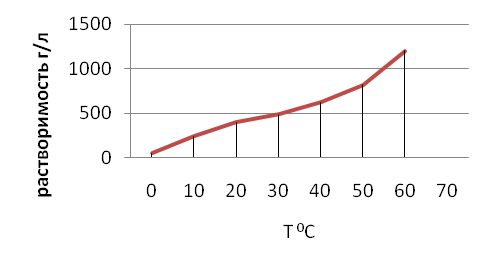 |
0 |
50 |
|
10 |
240 |
|
20 |
400 |
|
30 |
490 |
|
40 |
620 |
|
50 |
820 |
|
60 |
1200 |
|
70 |
? |
Калийная селитра используется как азотное минеральное удобрение, ускоряющее рост растения и увеличение зеленной массы, однако необходимо разумно его использовать.
( Сообщение учащегося о влиянии нитратов – 5 мин)
При растворении мы заметили, что при растворении стенки пробирки стали холодными, хотя добавляли воду комнатной температуры. Какой вывод мы можем сделать?
( Растворения является физико – химическим процессом, идущим с поглощением или выделением тепла. )
А). Перемешивание - физическое явление
Б). Изменение температуры -химическое явление
Растворенное вещество дробиться, смешивается с водой, образуя непрочное соединение.
(Схема растворения кристаллического сахара в воде (вода – растворитель)
Например :
вода + спирт, понижение температуры
вода + серная кислота, повышение температуры
вода + нитрат аммония, понижение температуры
Растворы- вещества переменного состава. От количественного состава зависят и его свойства. То что в повседневной жизни мы называем водой, является раствором. В воде хорошо растворяются газы, жидкости и твердые вещества.
Приведите примеры растворов, которые мы знаем.
( Раствор кислорода в воде ,раствор сероводорода- источники в пос. Белый Яр, уксусная кислота, раствор серной кислоты в аккумуляторах, раствор сахара, раствор поваренной соли)
Но не все вещества растворимы в воде. Поэтому в “ Таблице растворимости” мы можем найти : растворимые вещества, нерастворимые, малорастворимые. ( Объяснить, как пользоваться таблицей)
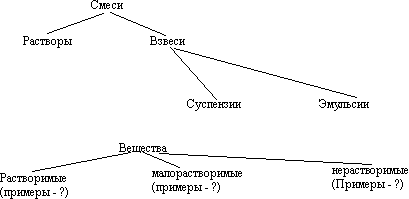
Растворы:
- насыщенные
- ненасыщенные
- пересыщенные
III. Рефлексия.
Ответить на вопросы.
- Какие растворы вы используете в быту? Приведите примеры
- Домашний эксперимент. Приготовить пересыщенный раствор поваренной соли и вырастить кристаллы. ( описание эксперимента в учебнике)
- Составить кластер по воде и ее свойствам .Например такой.(рисунок3)
Выполните задание:
- Заполните пропуски. Вода-………….растворитель. В ней растворяются многие твердые вещества-….., жидкие вещества………., газообразные. Именно поэтому в природе нельзя обнаружить ………воду. В результате растворения образуются смеси, называемые…….
- Растворимость веществ в воде зависит, прежде всего, от природы вещества. Пользуясь таблицей растворимости веществ ,определите и запишите формулы и названия следующих:
- Определите растворимость следующих веществ : карбонат кальция, сульфат натрия, сульфид натрия, хлорид калия.
- Рассмотрите график растворимости некоторых солей ( учебник)и дайте ответ:
- Как вы думаете? Почему при открывании бутылки с газированной водой образуется обильная пена?
- Раствор называется концентрированным, если в определенном объеме содержится………..
- Какой раствор более концентрированный,
А)соль, растворимая в воде……..
Б) соль, нерастворимая в воде…..
В)кислота ,растворимая в воде…..
Г) кислота нерастворимая воде…..
Д)малорастворимая соль в воде……
Как изменяется растворимость сульфата натрия и хлорида натрия при повышении температуры?
При какой температуре растворимость солей - сульфата калия, нитрата бария и хлората калия практически одинаковая ?
При какой температуре растворимость поваренной соли будет больше –при 60 или при 1000С?
а) содержащий 0.5 моль/л или 0.2 моль/л.
б)уксус 9% или 70%.