Интегрированный урок физики по теме:
«Электрический ток в жидкостях».
Учителя: Скоморохова Н.В. - учитель химии Резниченко Л.А. - учитель физики
Цели и задачи урока:
Образовательная:
| Физика | продолжить формирование понятия тока в различных средах, ознакомить учащихся с проводимостью жидкостей, растворов и |
| Химия | электролитов, вывести закон Фарадея. Обеспечить усвоение изакрепление нового материала, расширить знания учащихся,продолжить формирование понятия «электролиза», формирование понятия единства теории и практики. Обеспечить повторение и закрепление материала. |
| Развивающая: | выделить главное в большом объеме информации при помощи опорного конспекта. Сопоставлять понятие процесса электролиза с физической и химической точки зрения. Развивать познавательный интерес. |
| Воспитательная: | продолжить формирование представлений о связи природы и духовного мира человека, учить находить и воспринимать прекрасное в природе и трудовой деятельности, готовить к сознательному выбору профессии на основе политехнических знаний |
| Оборудование: | плакаты, лабораторное оборудование для проведения практической работы, план-карты, дополнительная литература. |
Ход урока
Учитель физики:
(На доске написана тема урока, схемы, рисунки механизма растворения кристалла хлорида натрия)
(Учитель объясняет тему учащимся)
Сегодня тема нашего урока «Электрический ток в жидкостях». С проводимостью электрического тока в растворах вы уже немного знакомы из курса химии, и поэтому сейчас мы повторим этот материал.
Мы с вами вспомним теорию электролитической диссоциации и попытаемся провести единую линию в этом процессе с точки зрения химии и физики. Для этого проведем лабораторный опыт: (учитель показывает опыт, и на все поставленные вопросы отвечают учащиеся)
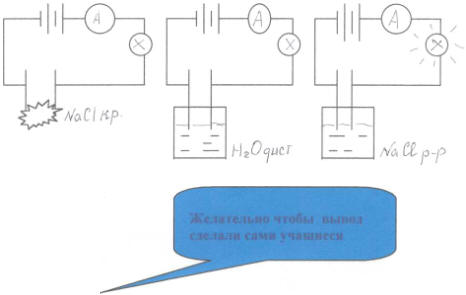
Возьмем три стакана:
1/ Кристаллическая соль хлорида натрия
2/ Дистиллированная вода
3/ Раствор хлорида натрия
Опустим электроды в каждый стакан, что мы наблюдаем?
1/ лампочка не засветилась
2/ лампочка не засветилась
3/ лампочка засветилась
Почему? Объясните с точки зрения физики по схемам.
Учитель физики:
Давайте рассмотрим с вами схемы трех опытов. Почему в первых двух случаях лампочка не засветилась, а в третьем случае -засветилась?
разрушается с образованием гидратированных ионов. Они и являются проводниками тока. Распад электролита на ионы при растворении в воде называется ЭЛД.
Учитель физики:
Итак, мы выяснили, как появились ионы. Образовавшиеся ионы участвуют в хаотичном тепловом движении. Если ионы разных знаков сближаются на достаточно близкое расстояние, то они могут образовать молекулу. Процесс - рекомбинации. Это обратный процесс - диссоциации. Диссоциация определяется степенью диссоциации, отношением числа продиссоциированных молекул на ионы к общему числу молекул. Если число продиссоциированных молекул в единицу времени равно числу рекомбинируемых за это же время, то наступает динамическое равновесие.
Рассмотрим две схемы:
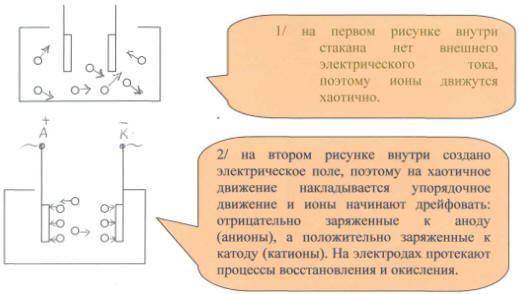
Сделаем вывод:
Дистиллированная вода и кристаллическая соль являются диэлектриками, а раствор хлорида натрия - проводник. Откуда взялись носители зарядов? С этим вопросом нам поможет разобраться химия.
Учитель химии:
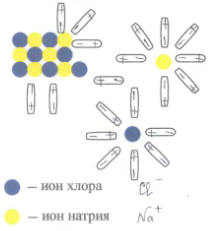
Рассмотрим процесс растворения кристалла хлорида натрия в воде, /выходит ученик к доске и объясняет вопрос по рисунку и записывает уравнение диссоциации хлорида натрия/ (молекула воды — диполь) полярная молекула, обладающая высокой диэлектрической проницаемостью. Кристалл хлорида натрия окружают полярные молекулы воды. Положительно заряженный ион натрия окружают диполи воды отрицательными ионы хлора.
Окислительно - восстановительный процесс, протекающий на электродах при пропускании электрического тока через раствор или расплав называется - электролизом. Что же такое электролиз с точки зрения химии и как протекают процессы на электродах, вы рассмотрите с учителем химии.
Учитель химии:
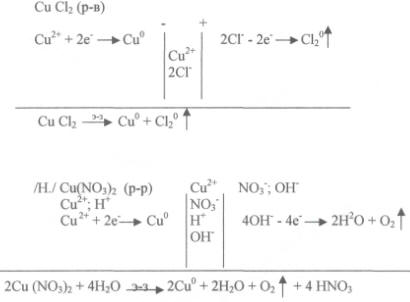
Рассмотрим электролиз расплава хлорида меди и раствора нитрата меди, (к доске вызывается два ученика, которые записывают схемы электролиза и составляют уравнения реакций, протекающих на электродах, а затем объясняют.)
Учитель физики:
Рассмотрев теорию диссоциации и электролиза с химической точки зрения, мы можем использовать данные процессы для расчетов массы вещества. Рассмотрим закон электролиза. Зная механизм электропроводимости электролитов, можно определить массу выделившегося вещества при электролизе:
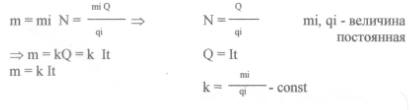
Масса вещества, выделяющаяся на электроде, прямо пропорциональна общему заряду, прошедшему через электролит.
Закон Фарадея 1832 год.
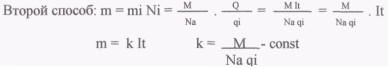
Используя закон Фарадея, можно определить заряд электрона. Применение электролиза: (заранее дать нескольким к учащимся сообщения по применению электролиза) Учитель химии: Для закрепления темы проведем лабораторный опыт:
1 вариант : Проводят электролиз раствора иодида калия.
Задание: провести электролиз раствора иодида калия, доказать и объяснить направленность движения ионов, произвести расчет.
Задача: вычислить объем водорода, выделявшийся на катоде при электролизе 150 г. раствора, содержащего 5% иодида калия.
2 вариант: Проводят электролиз раствора сульфата меди.
Задание.провести электролиз раствора сульфата меди, определить массу меди, выделившейся на катоде, за промежуток времени 15 мин. Задача: рассчитать массу используя формулы, рассчитать заряд электрона меди, выделившейся на катоде,

Учитель физики:
(подводит итоги урока)
Я надеюсь, что, используя знания химии, мы смогли шире и глубже понять процесс проводимости тока в жидкостях.
Я надеюсь, что, используя знания химии, мы смогли шире и глубже понять процесс проводимости тока в жидкостях.