Цели урока:
- дать понятие об ароматической связи, её особенностях, установить взаимосвязь между строением бензола и его свойствами;
- закрепить умение сравнивать состав и строение углеводородов различных рядов;
- познакомить с физическими свойствами бензола;
- показать токсическое воздействие аренов на здоровье человека.
План лекции
- Вывод молекулярной и структурной формулы бензола.
- История открытия бензола.
- Формула Кекуле.
- Строение бензола.
- Понятие “ароматичности”.
- Возникновение термина “ароматические соединения”.
- Физические свойства бензола.
- Токсическое воздействие аренов на организм человека.
- Закрепление пройденного материала.
- Домашнее задание.
В начале урока предлагаю учащимся решить задачу на вывод формулы вещества.
Задача. При сжигании 2,5 г вещества выделилось 8,46 г углекислого газа и 1,73 г воды. Масса 1 л вещества составляет 3,5 г. Определите молекулярную и возможную структурную формулы вещества.
Решая задачу, учащиеся выводят молекулярную формулу вещества – С6Н6. Возникает проблемная ситуация: “Какое строение может иметь молекула бензола?” Опираясь на знание о непредельных углеводородах, учащиеся предлагают возможные структурные формулы для него:
НС ![]() С—СН2—СН2—
С
С—СН2—СН2—
С ![]() СН
СН
Н2С = СН —С ![]() С—СН =
СН2 и другие.
С—СН =
СН2 и другие.
Учащиеся делают вывод о том, что бензол является сильно ненасыщенным соединением, вспоминают качественные реакции на непредельность.
Предлагаю учащимся проверить гипотезу о непредельности бензола в ходе выполнения эксперимента. Проведя реакции бензола с бромной водой и раствором перманганата калия, ученики приходят к выводу, что бензол, являясь ненасыщенной системой, не даёт качественных реакций на непредельность, следовательно, его нельзя отнести к классу непредельных углеводородов.
Какое же строение имеет молекула бензола, и к какому классу углеводородов его можно отнести?
Прежде, чем ответить на этот вопрос, знакомлю учеников с историей открытия бензола, которая весьма интересна. В 1812 – 1815 годах в Лондоне впервые появилось газовое освещение. Светильный газ, добывавшийся из жира морских животных, доставлялся в железных баллонах. Эти баллоны помещались обычно в подвале дома, из них газ по трубкам распределялся по всему помещению. Вскоре было замечено крайне неприятное обстоятельство – в сильные холода газ терял способность давать при горении яркий свет. Владельцы газового завода в 1825 г. обратились за советом к Фарадею, который нашёл, что те составные части, которые способны гореть ярким пламенем, собираются на дне баллона в виде прозрачного жидкого слоя. При исследовании этой жидкости Фарадей открыл новый углеводород – бензол. Название этому веществу дал Либих – (суффикс –ол указывает на его маслянистый характер, от латинского oleum – масло).
Далее перехожу к изложению строения молекулы бензола.
В 1865 г. немецким учёным Кекуле была предложена структура молекулы бензола, которая приснилась ему в виде змеи, укусившей себя за хвост:

Но эта формула, соответствуя элементарному составу бензола, не отвечает многим его особенностям:
- бензол не даёт качественных реакций на непредельность;
- для бензола характерны реакции замещения, а не присоединения;
- формула Кекуле не в состоянии объяснить равенства расстояний между углеродными атомами, что имеет место в реальной молекуле бензола.
Чтобы выйти из этого затруднения, Кекуле допустил, что в бензоле происходит непрерывное перемещение двойных связей.
Использование современных физических и квантовых методов исследования дало возможность создать исчерпывающее представление о строении бензола.
Атомы углерода в молекуле бензола находятся во
втором валентном состоянии (sp2). Каждый атом
углерода образует ![]() -связи с
двумя другими атомами углерода и одним атомом
водорода, лежащими в одной плоскости. Валентные
углы между тремя
-связи с
двумя другими атомами углерода и одним атомом
водорода, лежащими в одной плоскости. Валентные
углы между тремя ![]() -связями
равны 120°. Таким образом, все шесть атомов
углерода лежат в одной плоскости, образуя
правильный шестиугольник (рис. 1):
-связями
равны 120°. Таким образом, все шесть атомов
углерода лежат в одной плоскости, образуя
правильный шестиугольник (рис. 1):
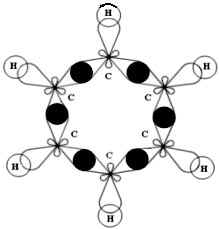
Рис. 1. Схема образования ![]() -связей
-связей
в молекуле бензола
Каждый атом углерода имеет одну негибридную
р-орбиталь. Шесть таких орбиталей располагаются
перпендикулярно плоскости ![]() -связей
и параллельно друг другу (рис. 2). Все шесть
р-электронов взаимодействуют между собой,
образуя единое
-связей
и параллельно друг другу (рис. 2). Все шесть
р-электронов взаимодействуют между собой,
образуя единое ![]() -электронное
облако. Таким образом, в молекуле бензола
осуществляется круговое сопряжение. Наибольшая
-электронное
облако. Таким образом, в молекуле бензола
осуществляется круговое сопряжение. Наибольшая ![]() -электронная плотность в этой
сопряженной системе располагается над и под
плоскостью кольца (рис. 3):
-электронная плотность в этой
сопряженной системе располагается над и под
плоскостью кольца (рис. 3):
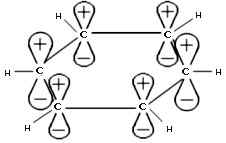 Рис 2. Негибридные
2p-орбитали |
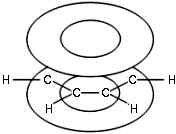 Рис 3. Молекула
бензола. |
В результате такого равномерного перекрывания 2р-орбиталей всех шести углеродных атомов происходит “выравнивание” простых и двойных связей – длина связи составляет 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). То есть, в молекуле бензола отсутствуют классические двойные и одинарные связи.
Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения – количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, почему бензол трудно вступает в реакции присоединения – это приводит к нарушению сопряжения. Такие реакции возможны в жёстких условиях.
В настоящее время нет единого способа
графического изображения молекулы бензола с
учётом его реальных свойств. Но, чтобы
подчеркнуть выравненность ![]() -электронной
плотности в молекуле бензола, прибегают к помощи
следующих формул:
-электронной
плотности в молекуле бензола, прибегают к помощи
следующих формул:
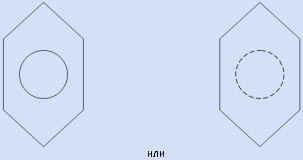
Используют и формулу Кекуле, помня при этом о её недостатках.
Совокупность свойств бензола принято называть
ароматичностью. В общем виде явление
ароматичности было сформулировано немецким
физиком Хюккелем: соединение должно проявлять
ароматические свойства, если в его молекуле
содержится плоское кольцо с (4n+2) ![]() -электронами, где n может принимать
значения 0, 1, 2, 3 и т. д. Согласно этому правилу,
системы, содержащие 6, 10, 14
-электронами, где n может принимать
значения 0, 1, 2, 3 и т. д. Согласно этому правилу,
системы, содержащие 6, 10, 14 ![]() -электронов,
являются ароматическими.
-электронов,
являются ароматическими.
Примерами таких соединений являются нафталин (n=2) и антрацен (n=3).
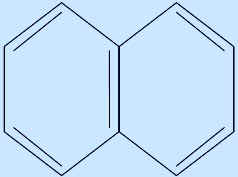 нафталин (10 |
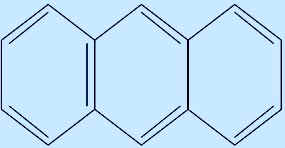
|
После рассмотрения строения бензола с учащимися обсуждаем ответы на вопросы:
- Можно ли отнести бензол к непредельным углеводородам? Ответ обоснуйте.
- К какому классу углеводородов относится бензол?
- Что подразумевается под понятием “ароматическое соединение”?
- Какие углеводороды называются ароматическими?
Далее знакомлю учащихся с происхождением термина “ароматические соединения”. Сообщаю, что это название возникло в начальный период развития химии. Было замечено, что соединения бензольного ряда получаются при перегонке некоторых приятно пахнущих (ароматических) веществ – природных смол и бальзамов. Однако большинство ароматических соединений не имеют запаха или пахнут неприятно. Но данный термин сохранился в химии. Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с особым характером связей.
Далее учащиеся знакомятся с физическими свойствами бензола, работая с учебной литературой. Им известно, что бензол – это жидкость, может находиться и в парообразном состоянии (при исследовании запаха). Знакомлю учащихся с бензолом в твёрдом виде. Температура плавления бензола 5,5°С. Основываясь на этом сведении, демонстрирую превращение жидкого бензола в белую кристаллическую массу. Для этого 4-5 мл бензола, находящегося в пробирке, опускаю в сосуд, наполненный снегом или льдом. Через несколько минут учащиеся наблюдают изменение агрегатного состояния бензола. На основании наблюдений учащиеся высказывают предположение о том, что у этого вещества должна быть молекулярная кристаллическая решетка.
Обращаю внимание учащихся на то, что бензол является сильно токсичным веществом. Вдыхание его паров вызывает головокружение и головную боль. При высоких концентрациях бензола возможны случаи потери сознания. Его пары раздражают глаза и слизистую оболочку.
Жидкий бензол легко проникает в организм через кожу, что может привести к отравлению. Поэтому работа с бензолом и его гомологами требует особой осторожности.
Материал темы “Бензол” использую для объяснения вреда курения. Исследования дёгтеобразного вещества, полученного из табачного дыма показали, что в нём содержатся, помимо никотина, ароматические углеводороды типа бензпирена,
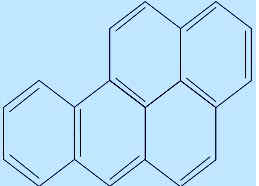
обладающие сильными канцерогенными свойствами, т. е. эти вещества действуют как возбудители рака. Табачный дёготь при попадании на кожу и в лёгкие вызывает образование раковых опухолей. Курильщики чаще заболевают раком губы, языка, гортани, пищевода. Они намного чаще страдают стенокардией, инфарктом миокарда. Отмечаю, что около 50% ядовитых веществ курильщик выделяет в окружающее пространство, создавая вокруг себя кольцо “пассивных курильщиков”, у которых быстро появляется головная боль, тошнота, общее недомогание, а затем могут развиваться и хронические заболевания.
В конце урока провожу фронтальный опрос по вопросам:
- Какое количество
 -связей
образует каждый атом углерода в молекуле
бензола? Сколько всего
-связей
образует каждый атом углерода в молекуле
бензола? Сколько всего  -связей
имеется в ней?
-связей
имеется в ней? - Какие связи в молекуле бензола локализованы?
- Почему длина связи между атомами углерода в молекуле бензола является промежуточной между одинарной и двойной?
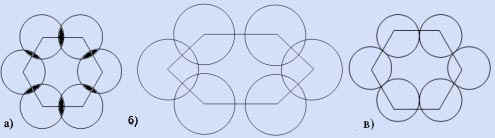
- Какая из схем правильно показывает образование
 -связей в молекуле бензола?
Ответ мотивируйте.
-связей в молекуле бензола?
Ответ мотивируйте.
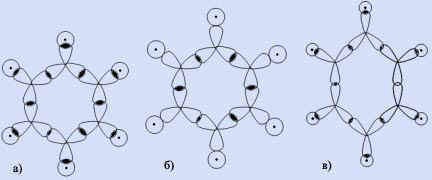
- Объясните, какая схема верно отображает
расположение
 -электронного
облака в молекуле бензола?
-электронного
облака в молекуле бензола?
Домашнее задание: стр.55-58, стр. 61 №1, 2 по учебнику Э. Е. Нифантьева, Л. А. Цветкова “Химия 10-11”.