Цели занятия:
Образовательная - формирование единых взглядов на природу электрического тока на примере электролиза, изучение законов электролиза при его практическом применении в аккумуляторах.
Развивающая - формирование умения объяснять новые, ранее неизвестные явления и применение их на практике путём составления логических цепочек и проведения аналогий.
Воспитательная - формирование и развитие речевого аппарата.
Оснащение занятий:
Оборудование и материалы: источник тока, набор для электролиза, амперметр, вольтметр, ключ, соединительные провода, раствор медного купороса, дистиллированная вода, автомобильный аккумулятор.
ТСО и учебно-наглядные пособия: кодоскоп, плакат “Устройство аккумулятора”, кроссворд “Физические понятия, применяемые при изучении электролиза”, кодопленки с рисунками и уравнениями электролиза, таблицы с новой терминологией и формулами.
Раздаточный материал: карточки с вопросами для начального среза знаний; чистые листы для ответов.
На занятии, предшествующем данному уроку, учащиеся получили задание повторить тему “Законы постоянного тока”. Тема “Окислительно-восстановительные реакции при электролизе” по предмету химия изучена накануне данного урока.
Ход урока
Вступление. Каждый современный человек должен знать устройство и принцип действия такого сложного транспортного средства как автомобиль.
Создание практической проблемной ситуации.
В жизни автомобилиста часто возникают нестандартные затруднительные ситуации, достойно выйти из которых помогает знание законов физики. Вот одно из доказательств этого.
Два водителя, имеющие автомобили одинаковой марки, одного года выпуска, одинакового технического состояния и параметрами при низкой температуре воздуха производят запуск двигателя. Первый водитель после пяти попыток окончательно посадил аккумулятор. Второй водитель перед запуском включил на 3-4 минуты свет фар, и двигатель запустился стартером с первой попытки. В чем причина?
Ответ уч-ся: Вариант (а). Среди ваших ответов не прозвучал правильный ответ. Вернемся к этой проблеме в конце урока после изучения данной темы.
Вариант (б). В холодное время года необходимо разогреть аккумулятор током небольшой силы и возобновить (оживить) реакцию электролиза внутри аккумулятора. Эта задача успешно решается при включении приборов освещения.
Учитель: Чтобы не допустить подобные ситуации, необходимо определить, какое физическое явление лежит в основе данного процесса и на основе законов физики устранить проблему. Сегодня мы проведем урок, на котором будем изучать вопросы физики, рассматривать химические процессы, знакомиться с техническим применением электрических явлений, и очень важно, чтобы вы убедились в единстве законов природы и ее проявлений. Тема урока: “Электрический ток в жидкостях. Законы электролиза. Применение электролиза”.
I. Опрос. Учитель. В начале мы проверим, что вы знаете уже из ранее изученных понятий на уроках химии, физики: проведём начальный срез знаний. Вы должны письменно ответить на предложенные вам вопросы в индивидуальных карточках (Приложение 1) в течение 5 минут.
Учитель раздает карточки. Учащиеся сдают свои ответы по истечении времени.
Учитель проверяет ответы, внося результаты начального среза в бланк рейтинга знаний по данной теме. Во время всего занятия учитель в бланке рейтинга выставляет баллы за правильные ответы и активную работу учащихся.
II. Актуализация опорных знаний
Учитель: В рабочих тетрадях запишите тему урока (на доске). Вспомним основные физические понятия электрического тока, условий его создания. (На экране с помощью кодоскопа проецируется конспект “Условия существования электрического тока. Законы Ома для полной цепи и для участка цепи”. Приложение 2).
III. Изложение нового материала
Процесс создания электрического тока в жидкостях
Учитель. Рассмотрим процесс возникновения тока в жидкостях. Соберем цепь по схеме (Рис. 1). Она содержит: источник тока, ключ, амперметр, вольтметр, стеклянный сосуд с жидкостью, два угольных электрода с темного цвета поверхностями (демонстрируем состояние поверхностей угольных стержней), соединительные провода.
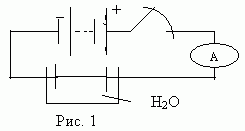
Проведем два опыта. Вы должны будете проанализировать результаты наблюдений и сделать вывод.
Опыт 1. Замкнем ключ. (Сила тока равна нулю). Объясните, почему?
Опыт 2. Добавляем в воду раствор медного купороса. Замыкаем ключ. (Амперметр показывает значение силы тока). (Рис. 2). Итак, каковы результаты наблюдений и ваш вывод?
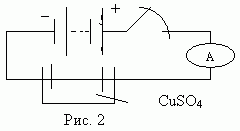
Эталон ответа: В первом опыте в сосуде между электродами была дистиллированная вода с диэлектрической проницаемостью e =81. Отсутствие свободных носителей заряда является причиной отсутствия тока в цепи, несмотря на наличие электрического поля между электродами. Во втором опыте в воду добавили раствор медного купороса и в растворе появились свободные заряженные частицы, которые под действием электрического поля начинают двигаться упорядоченно. Жидкость стала проводником. Начертите схему цепи в тетрадях и запишите вывод.
Вывод 1: Чистые жидкости, как правило, заметной электропроводностью не обладают.
Рассмотрим процесс в растворе медного купороса подробнее.
При растворении в воде солей, кислот, щелочей под воздействием полярных молекул воды образуются положительные ионы (катионы) и отрицательные ионы (анионы). Этот процесс называется электролитической диссоциацией:
Cu So4>Cu2++SO2-4 (1)
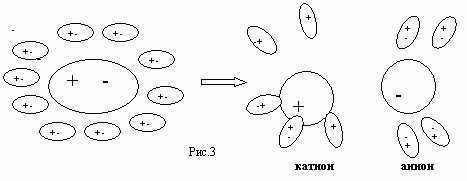
Одновременно происходит и обратный процесс - образование из ионов нейтральных молекул - в этот процесс называется рекомбинацией:
Cu2++SО2-4>CuSО4 (2)
Раствор, состоящий из молекул, катионов и ионов, называется электролитом.
Подумайте и ответьте: Что еще может вызвать распад молекул на ионы помимо растворителя?
Подсказка: Вспомните, как связаны температура и внутренняя энергия вещества?
Эталон ответа: При повышении температуры электролита растет кинетическая энергия всех его молекул и частицы, из которых молекулы состоят, способны преодолеть молекулярное притяжение и произойдет процесс диссоциации. Сделаем вывод и запишем его.
Вывод 2: Электрический ток в растворах солей, кислот, щелочей и в расплавах солей обусловлен упорядоченным движением положительных, отрицательных ионов и свободных электронов.
Зависимости силы тока от напряжения на участке цепи, содержащей электролит, и от температуры электролита.
Учитель. Существование электрического тока в цепях подчиняется законам Ома.
Обратимся к опыту и проверим выполнение закона Ома на участке цепи, содержащей электролит. В цепи, изображенной на схеме 1, будем изменять напряжение, и определять соответствующие ему значение силы тока в цепи. Результаты занесем в таблицу.
Табл.1
| Uв | ||||||||
| IА |
Построим график вольт - амперной зависимости:
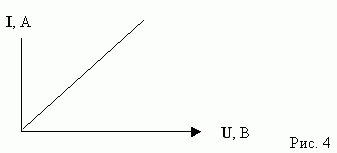
Из полученного графика, какой вывод мы можем сделать?
Вывод3. На участке цепи, содержащей, электролит, выполняется закон Ома.
![]()
Исследуем зависимость силы тока в цепи от температуры электролита.
Как вы считаете, должно измениться или нет значение силы тока? И если да, то как?
Эталон ответа. При повышении температуры процесс электрической диссоциации протекает более интенсивно, так как увеличивается число положительных и отрицательных ионов и растет их подвижность, (вязкость электролита уменьшается), а все это ведет и к увеличению силы тока в электрической цепи (I = q/t).
Учитель. Проверим наш вывод на опыте. Нагреем раствор медного купороса с помощью кипятильника, не меняя всех остальных параметров (демонстрирует процесс нагревания электролита).
При нагревании электролита сила тока увеличилась , т.к. I1=……А, I2=……А, следовательно, сопротивление уменьшается и его обратно пропорциональная зависимость от температуры имеет следующий вид: R
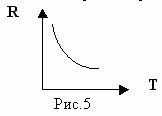
Вывод 4. При нагревании электролитов уменьшается их вязкость и сопротивление, а проводимость растет.
Законы электролиза
Перейдем к рассмотрению главного назначения существования электрического тока в электролитах. Электрический ток протекал через электролит некоторое время. Разомкнем цепь и посмотрим на состояние поверхностей электродов.
Поверхность анода не изменилась. Какие ионы двигались в его направлении?
Правильно, анионы. Катод - к нему двигались катионы, т.е. ионы меди, - приобрел красноватый оттенок. Этот факт указывает на присутствие меди на поверхности катода.
Какое заключение вы можете сделать на основании этого результата?
Эталон ответа. На катоде выделилась медь.
Вывод 5. Процесс выделения на электродах вещества, связанный с окислительно-восстановительной реакцией, называется электролизом.
Выясним, от чего зависит масса вещества, выделившегося на катоде. Прошу выдвинуть ваши гипотезы. Ответы учащихся записываются на доске.
Учитель. Ваши предположения верны и полностью совпадают с выводами, сделанными 170 лет назад в 1834 году великим английским ученым Майклом Фарадеем. На основании многочисленных опытов он сформулировал законы электролиза.
1 закон электролиза: масса, выделившего на электроде вещества прямо пропорциональна величине заряда, протекшего через электролит.
m = k * q (4)
где k - это электрохимический эквивалент, который измеряется массой выделяющегося на катоде вещества при прохождении через электролит единицы заряда.
k = m / q (5)
А так как q=I * t, получаем: m =k * I * t (6)
Физический смысл первого закона электролиза
Положительные ионы (катионы) при соприкосновении с катодом получают недостающие электроны и осаждаются на катоде в виде нейтральных атомов. Отрицательные ионы (анионы) при соприкосновении с анодом отдают лишние электроны и осаждаются на аноде. Поскольку массы ионов mi определенного вида точно одинаковы, то общая масса всех ионов пропорциональна их числу Ni. А это означает, что масса выделенного при электролизе вещества должна быть прямо пропорциональна заряду, прошедшему через электролит.
Чем больше заряд, прошедший через электролит, тем больше число ионов его переносящих, а, следовательно, и больше масса выделившегося на электродах вещества.
q = qi * Ni (7) => m = mi * Ni (8)
Выясним теперь, от чего зависит величина электрического эквивалента k.
Введем обозначение i - ион, n - валентность, e -заряд электрона, qi = е * n - заряд иона, М - молекулярная масса, mi = М / NA -масса иона, М / n - химический эквивалент вещества.
Подставим в (5) k = m / q формулы (7) и (8);
k = mi Ni / mi * Ni = М / NA * е * n (9)
Поясним данный вывод: в результате своих опытов Фарадей нашел, что для выделения на электроде одного химического эквивалента ионов любого вида (M / n) нужно пропустить через электролит одинаковый электрический заряд q = NА е = F (10)
F - “постоянная Фарадея”. F = 965000 Кл/моль.
Вывод 6. 2-ой закон электролиза: Электрохимические эквиваленты различных веществ прямо пропорциональны их химическим эквивалентам.
k = М / NA е n
А из (7) и (10) получим окончательный результат.
m = 1 / F * M / n* I * t (11)
Вывод 7. Если через электролит проходит заряд q, вещества с химическим эквивалентом M/n, то масса выделившего вещества будет равна:
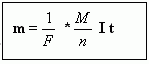 (11)
(11)
Уравнение (11) называется обобщенный закон электролиза
Прокомментируем вывод, обобщенного закона электролиза по нижеприведенной схеме
(Преподаватель дает комментарии по данной записи на кодопленке или на доске):
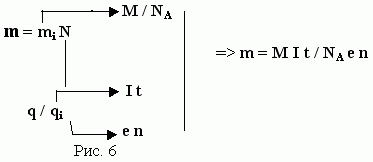
Те учащиеся, которые будет испытывать затруднения в выводе обобщенного закона электролиза, смогут воспользоваться данным выводом и прокомментировать его.
Используя закон Фарадея, е = F / NA, рассчитали заряд электрона: е = 1,6* 10-19 Кл, что хорошо совпадает с результатами опытов Иоффе и Милликена.
Итак, мы познакомились с законами электролиза. Какие у вас появились вопросы? (После ответов на заданные вопросы объяснение нового материала продолжается).
Применение электролиза в технике
Выделим некоторые примеры использования электролиза в технике.
Очистка таких технических металлов, полученных при выплавке из руды, как алюминий, натрий и литий.
Из растворов при электролизе извлекают цинк и никель. Получают атомарный кислород.
В электрометаллургии: С помощью электролиза производят покрытие металлических предметов слоем другого металла, не окисляющегося на воздухе, что предохраняет предметы от коррозии. Это процесс называется гальваностегией (на таблице выписан этот новый термин).
Получение рельефных металлических копий изображений с помощью электролиза называют гальванопластикой (на таблице выписан новый термин). Она была изобретена в 1837 году русским ученым Якоби.
Изготавливают таким способами клише для печатания денежных знаков, матриц для печатания книг.
Как вы думаете, что произойдет, если в электролит опустить пластины, выполненные из двух различных металлов?
Эталон ответа. Опыты показали, что если в электролит опустить пластины из двух различных металлов, то между ними возникнет разность потенциалов. А это и будет источник тока.
Какова природа ЭДС источника в этом случае?
Эталон ответа. ЭДС источника в этом случае
определяется работой сторонних сил химической
природы по перемещению единичного заряда ![]() . (12)
. (12)
Источники, в которых электрическая энергия получается за счет химической, называются гальваническими элементами в честь итальянского ученого Луиджи Гальвани, первым исследовавшим роль электрического поля в живом организме еще в 1775 году. В настоящее время ученые продолжают изучать процесс, как назвал его М.Фарадей, “превращения электрической силы в нервную”, происходящий в организме человека. Мы с вами упоминали при изучении темы “Электростатика” о падении напряжения на клеточной мембране живого организма. Очевидно, что мембрана, окруженная с обеих сторон растворами электролитов, может служить источником э.д.с. А так как толщина мембраны составляет всего 0,01-0,02 мкм, то биологический источник э.д.с. может иметь очень малые размеры. Создание источников э.д.с., аналогичных биологической мембране, найдет применение в миникомпьютерах.
Есть много других важных применений электролиза.
Далее, в ходе беседы учителя с учащимися решается предложенный кроссворд (один на весь класс), выполненный на плакате или доске.
IV. Закрепление
Повторим понятия, связанные с электролизом и, ответив на вопросы, предложенные в кроссворде, откроем слово, связанное с применением электролиза..
КРОССВОРД
1. Распад молекул электролита на ионы.
2. Образование молекул из положительных и отрицательных ионов электролита.
3. Процесс выделения на катоде вещества, входящего в состав электролита.
4. Единица измерения величины заряда в CИ.
5. Величина, характеризующая электролиз.
6. Величина, которая никогда не может быть равна абсолютному нулю.
7. Процесс воспроизведения форм предметов в матрицах.
8. Явление изменения качества электрода или концентрации ионов около него при прохождении тока через электролит.
9. Раствор, из которого может состоять электролит.
10. Пластина, находящаяся в электролите и подключенная к одному из полюсов источника тока.
11. Процесс пропускания тока от внешнего источника через электролит.
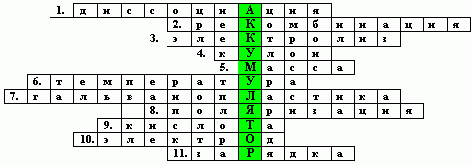
Итак, прочитаем слово по вертикали. “АККУМУЛЯТОР”. (Если слова поляризация, зарядка учащиеся не смогли вставить в кроссворд, а слово назвали, то вписать эти термины надо после изучения назначения аккумулятора).
V. Еще одно применение электролиза. Аккумуляторы - это приборы, которые становятся источниками электрической энергии после пропускания через них тока. При этом используется явление поляризации электродов, т.е. изменение качества их поверхности при прохождении тока через электролит. Поляризация может сохраняться в течение длительного времени после прекращения тока в электролите.
Рассмотрим окислительно-восстановительные реакции, протекающие в электролите. Познакомимся с принципом действия кислотного аккумулятора. (Схемы изображены на кодопленке).
Свинцовые электроды, помещенные в ванну с раствором серной кислоты, покрываются сернокислым свинцом PbSO4. Разность потенциалов между ними равна нулю (j 1- j 2 = 0).
Пропускание тока через аккумулятор называют его зарядкой. При подключении источника ток в электролите пойдет от положительного электрода к отрицательному (Рис.7).
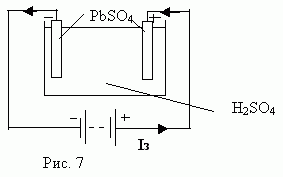
Наблюдается явление поляризации электродов, т.е. изменение качества поверхности электродов: на аноде образуется двуокись свинца PbO2, а на катоде - чистый свинец Pb. Поскольку пластины становятся разнородными, между ними создается разность потенциалов и прибор накапливает энергию. Если теперь вместо источника тока присоединить лампу накаливания, то при замыкании цепи лампа загорается. Использование аккумулятора в качестве источника называют разрядкой (Рис. 8).
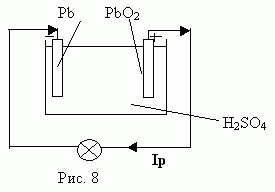
При разряде аккумулятора ток в электролите протекает от отрицательного электрода к положительному электроду. На отрицательной пластине происходит образование сернокислого свинца (PbSO4) в результате соединения свинца пластины с кислотным остатком (SO4) из электролита. На положительной пластине под действием разрядного тока - двуокись свинца (Pb O2) превращается также в сернокислый свинец (PbSO4), поглощая из электролита остаток (SO4) и отдавая в электролит кислород. Кислород с положительной пластины, соединяясь с водородом, оставшимся в электролите в результате распада серной кислоты, образует воду (H2O).
Реакции, происходящие при разрядке и зарядке аккумулятора, можно изобразить следующей химической формулой (на кодопленке).
PBSO4 + 2H2O + PBSO4
PBO2 + 2H2SO4 + PB (13)
При разрядке аккумулятора количество серной кислоты в электролите уменьшается и плотность электролита снижается. При зарядке аккумулятора реакции проходят в обратном порядке: количество серной кислоты в электролите увеличивается, а плотность электролита повышается. Свойство электролита изменять свою плотность при разряде и заряде аккумулятора используется в эксплуатации для определения степени заряженности аккумуляторной батареи.
Аккумуляторы характеризуются к.п.д. (![]() ), емкостью (С) и э.д.с. (e ).
), емкостью (С) и э.д.с. (e ).
Коэффициентом полезного действия аккумулятора называют число, показывающее, какую часть энергии, затраченной на его зарядку, он отдает при разрядке:
![]() =Ар/Аз
(14)
=Ар/Аз
(14)
Емкостью аккумулятора называют максимальное количество электричества, которое может пройти по цепи за все время разрядки аккумулятора. За единицу емкости обычно принимают ампер-час: 1 А*ч = 3600 Кл. Мы рассмотрели кислотный (или свинцовый) аккумулятор. Его э.д.с. составляет около 2В, а к.п.д. - около 80%. С устройством аккумулятора и принципом его действия вы можете познакомиться самостоятельно с помощью таблицы “Устройство аккумулятора” и пояснительного текста.
VI. Подведение итогов
Учитель. Подведем итоги. Думаю, сегодняшний урок не оставил сомнений в многообразии и единстве проявлений природы. Вы не только познакомились с новыми понятиями из курса “Физики”: электролиз, электрохимический эквивалент, гальваностегия, гальванопластика, аккумулятор, зарядка и разрядка аккумулятора, но и убедились в выполнении законов электролиза и разнообразии их применения во многих отраслях промышленности и в быту. Вспомним проблему запуска двигателя в морозный день двумя автомобилистами. (См. выше).
Учитель отмечает фамилии учащихся, активно работающих на уроке, называются или предлагаются для прочтения баллы, полученные каждым учащимся за урок и их эквивалент - оценка в журнале.
VII. Запишите задание на дом. Проработать конспект урока и подготовить ответы по всем разобранным вопросам. § 122 - 123 “Физика 10”, упр. 20 (6); подобрать примеры использования электролиза в быту, технике и природе.