При решении расчетных задач по предметам биология, география, химия всегда возникают проблемы с распределением учебного времени. Особенно при обучении решению химических расчетных задач. Это происходит потому, что основной теоретический материал по неорганической химии авторами практически всех учебных программ введен в курс восьмого класса. Соответственно и задачи почти всех типов также должны быть усвоены в восьмом классе. Такую нагрузку можно объяснить психологическими особенностями данного возраста. Передо мной всегда вставал вопрос, как облегчить ученикам восприятие и усвоение теоретического и практического материала? Мне показалось, что наиболее удачным решением этого вопроса будет создание тренажера для решения расчетных задач.
Целевое назначение этого тренажера в максимальном приближении к личностно-ориентированному обучению. Учащийся при работе с тренажером может рассчитывать и свои силы и время, усвоение темы происходит в удобном для ребенка режиме, есть возможность выбрать наиболее понятный способ при решении задачи. Так же возможно повышение мотивации через применение информационных технологий.
В химическом тренажере есть задачи на все типы. В качестве примера можно показать решение расчетных задач, если одно из реагирующих веществ взято в избытке.
Условие задачи:
Вычислить массу осадка, если в реакцию вступили 120 граммов сульфата натрия и 300 граммов хлорида бария.
Алгоритм:
Для решения необходимо записать краткое условие задачи (дано). Составить и записать уравнение реакции. Над уравнением выписать все условия из дано и обозначить искомую величину. Под уравнением выписать теоретическое количество веществ, участвующих в реакции. Далее вычислить количества веществ для масс, предложенных условием задачи, и вписать эти значения под уравнение реакции. Мы получим пропорцию.
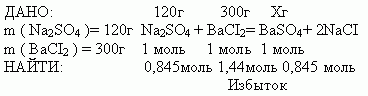
m (BaSO4 )
М (Na2SO4 )=142г/моль
M (BaCI2 )=208г/моль
М ( BaSO4)=233 г/моль
n = m/M.
Подставляем в формулу найденные значения.
n (Na2SO4 )=120/142=0,845 моль
n (BaCI2)=300/208=1,44 моль.
Из полученной пропорции видно, что хлорид бария дан в избытке. То есть он прореагирует не полностью, следовательно, полностью прореагирует сульфат натрия. Ищем массу полученного осадка сульфата бария, исходя из утверждения: так как теоретическое соотношение количеств вещества равно 1:1, то и практическое соотношение должно быть равным 0,845:0,845.
Воспользуемся формулой для проведения окончательных вычислений:
m ( BaSO4) = n M=233*0,845=196,88.
Записываем ответ: масса полученного осадка равна 196,88 граммов.
ЖЕЛАЮ УДАЧИ!
I УРОВЕНЬ
Задачи этого уровня точно повторяют алгоритм решения задач. Решив эти задачи, ты закрепишь свои знания.
- Вычислить массу соли, которая получится при взаимодействии 200 граммов серной кислоты и 220 граммов гидроксида натрия.
- Вычислить массу воды, которая получится при взаимодействии 100граммов гидроксида калия и 100 граммов азотной кислоты.
- Вычислить объем газа, который получится при взаимодействии 350 граммов карбоната кальция со 120 граммами соляной кислоты.
ОТВЕТЫ: 1) 284 грамма, 2) 28,57 грамм,3) 36,8 литра.

II УРОВЕНЬ
Этот уровень содержит задачи с измененным условием.
ДАВАЙ ПОПРОБУЕМ!!!
Для решения нужно вспомнить, как находится масса растворенного вещества, если известна масса раствора и его массовая доля.
- В реакцию нейтрализации вступили 100 граммов 5%-ного раствора азотной кислоты и 20 граммов гидроксида натрия. Вычислить массу получившейся соли.
- Вычислить массу осадка, образовавшегося при взаимодействии 520 граммов 10% раствора сульфида натрия и 405 граммов нитрата свинца.
- Определить массу соли, полученной при взаимодействии 25 граммов хлорида натрия и 300 граммов 15% раствора нитрата серебра, учитывать соль, выпавшую в осадок.

III УРОВЕНЬ
Если ты справился со вторым уровнем, то эти задачи для тебя не проблема.
ДАВАЙ РИСКНЕМ!!!
- Вычислить массы продуктов реакции между 250 граммами 10% раствора соляной кислоты и 180 граммами 20% раствора гидроксида кальция.
- Определить массу воды в реакции нейтрализации между 230 граммами 30%ного раствора серной кислоты и 250 граммами 16%ного раствора гидроксида натрия.
- Вычислить массу продуктов реакции между 300 граммами 26%ного раствора ортофосфорной кислоты и 290 граммами 12%ного раствора гидроксида бария

ТЕПЕРЬ ТЫ ГОТОВ К ПРОВЕРКЕ!
ПРОВЕРОЧНАЯ РАБОТА
I вариант
- Вычислить массу соли, которая образовалась при взаимодействии 25 граммов оксида кальция и 50 граммов воды.
- Вычислить массу воды, которая образовалась при реакции нейтрализации между 120 граммами 45%ного раствора соляной кислоты и 25 граммами гидроксида калия.
- Определить массы продуктов реакции между 340 граммами 5%ного раствора нитрата серебра и 260 граммами 3%ного раствора хлорида кальция.
II вариант
- Вычислить массу соли, которая образовалась при взаимодействии 30 граммов сульфата натрия и 15 граммов хлорида бария.
- Вычислить массу воды, которая образовалась при реакции нейтрализации между 200 граммами 20%ного раствора азотной кислоты и 15 граммами гидроксида натрия.
- Определить массы продуктов реакции между 126 граммами 15%ного раствора сульфата меди и 250 граммами 2%ного раствора гидроксида натрия.
ПОЗДРАВЛЯЮ, ТЫ УМЕЕШЬ РЕШАТЬ ЗАДАЧИ!!!
Химический тренажёр удобен тем, что можно легко рассчитывать время для работы. Его можно использовать в коллективных, индивидуальных и групповых формах деятельности.
Тренажер содержит следующие типы расчетных задач:
- Вычисление молекулярной массы.
- Вычисление массовой или объемной доли элемента в формуле.
- Нахождение молекулярной формулы по известным массовым или объемным долям.
- Нахождение молекулярной формулы по продуктам горения.
- Задачи на растворы.
- Расчетные задачи по уравнениям химических реакций.
- Задачи на вычисления, если одно из веществ взято в избытке.
- Определение удельной и относительной плотности.
- Вычисление состава смеси.
- Вычисления по термохимическим уравнениям.
- Комбинированные задачи.
- Задачи повышенной сложности.
Я работаю с тренажером уже четыре года. Иногда использую его в печатном виде, как раздаточный материал, а можно и в электронном виде, если задействовать компьютерный класс. (Презентация "Химический тренажер"). Учащиеся легко схватывают суть темы, отрабатывают основные моменты в удобном для себя режиме, учатся рассчитывать время и силы, привыкают к единому стилю работы.