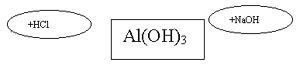Тема: Алюминий и его соединения
Цели:
расширить и углубить знания характеристики химического элемента на примере переходного металла – Алюминия в сравнении с металлами I и II групп на основании положения в периодической системе и строения атомов;
уметь предсказывать и доказывать химические свойства металла алюминия;
находить общее и отличное между металлами I и II групп, знать причины этого;
уметь записывать уравнения химических реакций, доказывающие химические свойства алюминия в ионном и окислительно–восстановительном виде;
закрепить понятие амфотерности; знать области применения алюминия и его соединений;
нахождение в природе нашего края.
Развивать умения:
ставить цели самообразовательной деятельности;
составлять план деятельности;
оценивать учебную деятельность своего товарища и умение работать в коллективе;
умение пользоваться справочной литературой.
Воспитание ответственности, патриотизма развитие творческих способностей учащихся.
Методы: частично–поисковый, творческий.
Приемы: работа в группе, К.Т.Д.
Стенд “Мой любимый город” (из AL сказки).
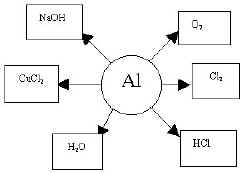
Оборудование: наборы химических реактивов AL+HCL, NaOH, H2SO4, ALCL3, бенгальские огни, изделия из AL, карточки–инструкции, справочники, коллекции промышленного сырья, шкала твердости, бумага, фломастеры, цветные фишки для оценки ответов.
План.
1. Организационный момент (распределение по группам).
2. Цели и задачи урока, составление плана.
Проблемный вопрос: В век господства какого металла мы живем? (Зная историю, перечислите прежние эпохи металлов)
Будет ли Железный век продолжаться в 21 веке? Или вслед за поэтом мы можем повторить:
“Новому времени
Новый костюм
Нужен для новых дел?”
Около 100 лет назад Чернышевский, увидев AL, сказал:
“Этому металлу суждено великое будущее”
Не пришло ли это время? Как мы сможем это доказать?
Станция “Информационная”
Путешествуя по миру металлов, выберем, найдем необходимые знания для решения проблемного вопроса
Конкурсное задание группам: Составить вопросы к рассмотрению, указать литературу; найти ответы. На листе бумаги приготовить кластер (схемы, ключевые слова, по которым можно восстановить знания). Предложите план изучения алюминия. Заготовим таблицу.
Пункты плана |
Вопросы к рассмотрению |
Литература |
Дома |
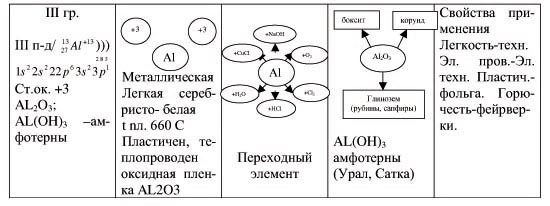
| 1 гр. Характеристика алюминия как химического элемента | 1) Положение AL в
периодической системе (сравнить с Ca). 2) строение атома AL 3) Степень окисления 4) Оксид и гидрооксид, их характеристика, причина амфотерности? 5) В природе |
Табл. Менделеева с.57(уч) с.59(уч) Энциклопедия с.72 кр. справ. 52 |
Описать подробно по плану |
| 2 гр. Характеристика простого вещества алюминия. предсказать |
|
Табл. Менделеева с. 58 (уч) Энциклопедия с.73 кр. справ. с.52 | |
| 3 гр. Химические св–ва AL |
Сост. схему хим. св–в AL
|
с.58(уч) | Составить уравнения в молек. и окисл. восст. виде (по схеме) |
Работая со справочной литературой, дополнительной литературой по AL можно найти массу интересных фактов. Мы пользуемся AL посудой, хотя алюминий находится рядом с активным кальцием.
– Могут ли быть AL изделия дороже
золотых?
– “Старение” – всегда ли это неприятное явление?
– В каких цистернах можно без боязни перевозить
кислоты HNO3, H2SO4?
– Всегда ли справедливо правило “От перемены
мест слагаемых сумма не меняется”?
– Почему AL фольга не сминается?
– Могут ли помочь знания об AL в приближении
любимого праздника – Нового года?
Пункты плана |
Вопросы к рассмотрению |
Лит–ра |
Дома |
4 гр. Соединения амония |
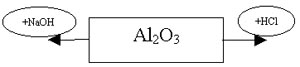
Амфотерный оксид!
Вывод: Амфотерный гидрооксид. В природе? |
уч.с.58–59
с.61(уч.) Энцикл. с.73 уч.с.59 (рис.15) |
Составить уравнение в молек. и ионном виде.
Составить уравнение в молек. и ионном виде. |
5 гр. Применение алюминия, основанное на свойствах. |
|
С.60 Энцикл.с.74 попул библ. х.э. с.199,219 |
Схема св–во – применение |
Станция “Экспериментальная”. (Почему горит красный сигнал светофора?)
Руководителям групп получить задания для исследования, исходя из реактивов, составить план работы и правила техники безопасности, поскольку работаем с опасными веществами.
1гр.: Взаимодействие AL с соляной и азотистой (конц.).
По описанию определите, какие реактивы и какое оборудование вам потребуется для работы. Заполните таблицу.
Оборудование и реактивы |
Для чего нужны |
Еще раз прочитайте описание работы. Какие опасности вас подстерегают при ее выполнении. Выпишите их и укажите, как их избежать.
Возможные опасности |
Меры предосторожности |
После выполнения работы составьте отчет по привычной для вас форме. В отчете не забудьте написать уравнения реакций и сформулировать выводы.
2гр.:Взаимодействие AL с серной кислотой (конц. р–р.).
Взаимодействие алюминия с растворами кислот
1. Аккуратно, чтобы не разбить дно, положите в пробирку одну гранулу алюминия.
2. Прилейте в ту же пробирку 2 мл раствора серной кислоты.
3. Повторите опыт, заменив кислоту на серную концентрированную.
4. Запишите наблюдения и дайте им объяснения.
3гр.:Взаимодействие AL с щелочью.
Взаимодействие алюминия с растворами щелочей
1. Аккуратно, чтобы не разбить дно, положите в пробирку одну гранулу алюминия.
2. Прилейте в ту же пробирку 2 мл 30 % –ного раствора гидроксида натрия..
3. Запишите наблюдения и дайте им объяснения
4гр.:Взаимодействие AL2O3 с кислотой и щелочью.
Взаимодействие алюминия с растворами кислот
1. Аккуратно, чтобы не разбить дно, положите в пробирку одну гранулу алюминия.
2. Прилейте в ту же пробирку 2 мл раствора соляной кислоты.
3. Повторите опыт, заменив соляную кислоту на концентрированную.
4. Запишите наблюдения и дайте им объяснения.
5гр.:Взаимодействие AL(OH)3 c кислотой и щелочью.
Уравнения реакций, выводы.
Получение и свойства гидроксида алюминия
1. В две пробирки налейте по 1 мл раствора хлорида алюминия.
2. В каждую пробирку добавляйте по каплям раствор гидроксида натрия до тех пор, пока не образуется осадок.
3. В первую пробирку прилейте раствор гидроксида натрия до полного растворения осадка.
4. Запишите наблюдения и дайте им объяснения.
5. Станция “Творческая”
Переходим к конкурсу защиты своего вопроса–задания
При защите своих заданий ребята используют найденный дополнительный материал, зачитывают строки из подготовленных сообщений к этой теме “Вспышка гения” (об открытии получения AL, 16–летний студент Чарлз Холл поставил задачу найти способ получения AL и в 21г. открыл способ получения AL.
Сценка встречи 2–х металлов AL и Fe
“Fe” AL –Эй, кто этот сундук сюда принес?
Ну–ка заглянем в него
–Так он твой, AL, подумаешь!
Да что там может быть,Алюминиевые ложки ложки да кастрюли. Вот мои изделия всегда нужны, и сотни лет назад, и сейчас. А ты что можешь показать?
–Ну, открывай свой сундук, кастрюльками набитый!
–Все ясно, в сундуке у тебя глиняные черепки.
Да раскрой свой секрет, не томи!
–Драгоценные камни? (изумление при открытии сундука)–Рубины, сапфиры– в основе AL2O3 небольшие количества др. металлов дают оттенки: красн. голуб.,AL входит в состав других минералов. (аквамарин, изумруд). Образуется в глубинах земли.
Закрепление
Конкурс на лучшего знатока аммония;
– Найти соответствие между применением и св–ми AL – прочитать слово, говорящее о природных запасах аммония.
Вывод: Так в каком веке мы живем? – AL
В заключении составим синквейн (белый стих по теме)
–Стой, не смей сундук открывать, не пришел еще черед!
–Погоди, узнаешь. Моя история самая необычная.
–Коль речь зашла о посуде – я здесь действительно незаменим.
Но ведь и древний человек использовал глиняную посуду, а фаянсовая посуда впервые изготовлена в18 веке у нас в Москве.
–Ну что ж смотри
В виде 1 сущ.
3 прилаг.
2 глаг.
Крылатой фразы “Не все то золото, что блестит”
Фейерверк: Лучший знаток и учитель зажигают бенгальские огни (AL).
Литература
1. Настольная книга учителя химии. О.С. Габриелян 9 кл., 2001 г, Москва.
2. Популярная библиотека хим. Элементов. И.В. Петрянов – Соколов. Москва “Наука”, 1971 г.
3. Занимательная химия. Нескучный учебник. В. Малышкина . 1998 г., Санкт–Петербург.
4. Школьный практикум. М.В. Зуева, Н.Н. Гара. Химия 8–9 класс, “Дрофа”, 1999 г.