Цели:
- дать понятие о сущности реакции обмена,
- продолжить формирование умения записывать уравнения и предвидеть продукты реакции,
- закреплять знания по классификации и названиям химических веществ и типам химических реакций,
- уметь наблюдать, рассуждать, говорить “химическим языком”;
- формировать опыт творческого мышления, памяти, внимания, наблюдательности,
- воспитывать коммуникативные навыки, интерес к предмету.
Оборудование:
- дидактический материал – карточки для работы по парам; тест для проверки знаний и кружочки с символами ионов;
- видеофильм;
- растворы веществ: NaOH, HCl, CuSO4 , Na2CO3;
- листочки (для записи текста “озвучки”).
ХОД УРОКА
1. Вступительное слово учителя.
Учитель. Мы продолжаем изучать
типы химических реакций.
Сегодня мы с вами познакомимся с ещё одним типом
реакции. Цель этого урока уметь распознавать
типы химических реакций, уметь расставлять
коэффициенты в уравнениях реакций. Сегодня вы
будете работать парами и самостоятельно.
На предыдущих уроках мы с вами познакомились с
некоторыми типами химических реакций. Давайте
вспомним :
- Какие реакции называются реакциями соединения?
- Какие реакции называются реакциями разложения?
- Какие реакции называются реакциями замещения?
2. Работа с карточками по парам.
Докончить уравнения реакций, расставить коэффициенты, указать типы химических реакций:
- ? + НСl --> ZnCl2 + Н2
- СаСО3 --> СаО + ?
- Си(ОН)2 --> Н2О + ?
- ВаО + SО3 --> ВаSО4
- Си(NО)3 --> СиО + NО2 + О2
3. Проверка выполненного задания.
5 человек выходят к доске, решают по одному уравнению реакции и объясняют их.
4. Самостоятельная работа. (10 минут)
Ученикам выдаются карточки.
Ученики читают вопрос, находят правильный ответ под буквой и ставят точку напротив данной цифры и данной буквы.
1 вариант.
1. Формула серной кислоты:
а) Н2 SO4,
б) H2 SO3,
в) H2CO3.
2. Формула карбоната калия:
а) КNO3,
б) К2СО3,
в) К2SO4.
3. Реакция соединения:
а) 2Н2О = 2Н2 + О2,
б) 2 КNО3 = 2КNO2 + O2,
в) СаО + СО2 = СаСО3.
4. Реакция разложения:
а) Н2 + С12 = 2 НС1,
б) СаСО3 = СаО + СО2,
в) Zn + 2 HCl = ZnCl2 + H2.
5. Реакция замещения:
а) 3 СиО +2 А1 = А12О3 +3 Си,
б) 4Fe +3 O2 = 2Fe2O3,
в) СиО + 2НС1 = СиС12 + Н2.
Вариант 2
1. Формула фосфорной кислоты:
а) Н3 РО4,
б) НNO3,
в) H2SO4.
2. Формула нитрата калия:
а) К2СО3,
б) КNO3,
в) КNО2.
3. Реакция соединения:
а) КОН + НС1 = КС1 + Н2О,
б) Fe(OH)2 = FeO + H2O,
в) SO3 + H2O = H2SO4.
4. Реакция разложения:
а) 6 Li +3 N2 = 2 Li3N,
б)2 KNO3 = 2KNO2 +3 O2,
в) 2 Н2О = 2Н2 + О2.
5. Реакция замещения:
а) 2А1 + 3 Н2SO4 = Al2( SO4)3,
б) СиО + НС1 = СиС12 + Н2О,
в) 3 Fe + 2 O2 = Fe 3O4
Вариант 3.
1. Формула угольной кислоты:
а) Н2СО3,
б) Н2SO4,
в) НNO3.
2. Формула хлорида натрия:
а) Na2CO3,
б) NaCl,
в) NaNO3.
3. Реакция соединения:
а) 2 NaOH + CuCl2 = 2NaCl + Cu(OH)2,
б) CuCl2 + Zn = ZnCl2 + Cu
в) Fe + S = FeS
4. Реакция разложения:
а) Zn +2 HCl = ZnCl2 + H2,
б) Cu(OH)2 = CuO + H2O,
в) Ca + O2 = 2 CaO.
5. Реакция замещения:
а) Fe +2 HCl = FeCl2 + H2,
б) SO3 + H2O = H2SO4,
в) K2O + H2O = 2 KOH.
Вариант 4.
1. Формула соляной кислоты:
а) HCl,
б) HNO3,
в) H2SO3.
2. Формула фосфата калия:
а) K3 CO3,
б) K3 PO4,
в) KNO3.
3. Реакция соединения:
а) KOH + HNO3 = KNO3 + H2O,
б) Cu(OH)2 = CuO + H2O,
в) K2O + H2O = 2 KOH.
4. Реакция разложения:
а) 2Na + Cl2 = 2 NaCl,
б) MgCO3 = MgO + CO2,
в) 2KOH + FeCl2 = Fe(OH)2 + 2KCl.
5. Реакция замещения:
а) CuCl2 + Fe = FeCl2 + Cu,
б) CuO +2 HCl = CuCl2 + H2O,
в) N2 + O2 = 2 NO.
5. Творческая работа.
Учитель. Давайте с вами немного отдохнём. Как вы отдыхаете, обычно, когда приходите домой из школы? Включаете телевизор. Вот и мы сейчас с вами посмотрим небольшой фильм. Но, к сожалению, мы купили с вами такую кассету, на которой изображение есть, а звука нет. Ваша задача внимательно посмотреть видеозапись, друг с другом посоветоваться и прокомментировать (или озвучить) этот фильм, придумать название фильма. На выданных листочках записываете фамилии и озвученный текст.
Демонстрация фильма: В штативе стоят 3 пронумерованных пробирки с прозрачными растворами. В каждую пробирку приливается по каплям бесцветная жидкость. В пробирке под №3 раствор стал малинового цвета.
Проверка выполненного задания.
Рассуждения учащихся: Выданные растворы исследуются индикатором. Бесцветный индикатор – фенолфталеин, им можно определить, где находится щёлочь. Значит, из 3-х выданных растворов надо определить щёлочь. В кислой и нейтральной среде фенолфталеин не изменяет своей окраски, а в щелочной меняет на малиновую, что было видно в пробирке №3.
Название фильма: “Определение щёлочи”
Озвучивание фильма: Для определения щёлочи используется фенолфталеин – бесцветная жидкость, которая в щелочной среде меняет окраску на малиновый цвет. При попадании фенолфталеина в пробирку под №1 цвет не изменился, значит в ней не щёлочь; при приливании во вторую пробирку фенолфталеина изменений тоже не происходит, значит и в этой пробирке нет щёлочи. Фенолфталеин при приливании в пробирку под № 3 изменил окраску на малиновый цвет. Из выданных растворов в пробирке под №3 находится щёлочь.
Листки с ответами сдаются на проверку.
7. Знакомство с новым материалом.
Учитель. Сегодня мы с вами познакомимся ещё с одним типом реакции – реакцией обмена. Реакции обмена идут между сложными веществами. Примером такой реакции служит реакция между растворами:
NаОН + НС1 = ?
Как вы думаете, какие вещества будут образовываться?
Рассуждения учащихся ( учитель на доске рисует кружочками):
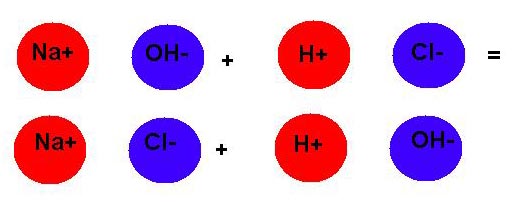
1. Вещество NаОН состоит из ионов: _____
2. вещество НС1 состоит из ионов:____
3. одноимённые заряды отталкиваются, а
разноимённые притягиваются, поэтому
положительные ионы меняются своими местами и
получается:
NаОН + НС1 = NaCl + H2O
Уравнение реакции дописывается в тетрадях и на доске.
Учитель. Перед вами растворы щёлочи и кислоты, растворы бесцветные, получается тоже раствор бесцветный. Как провести эту реакцию, чтобы было видно, что она действительно идёт?
![]()
Данная реакция называется реакцией нейтрализации. Как вы думаете, почему?
![]()
Учитель. Реакции нейтрализации – это частный случай большого типа реакции обмена, т.е не только кислота и щёлочь могут вступать в реакцию. Итак, реакция обмена – это реакция между сложными веществами Какие ещё сложные вещества могут вступать в реакции обмена? (соли, кислоты, основания, оксиды). Действительно, между этими веществами могут протекать реакции обмена. А для того, чтобы не ошибиться идёт эта реакция или нет, мы должны помнить условия течения реакции между растворами до конца. (Должен получиться осадок, газ)
Демонстрация опытов:
1. Реакция обмена с образованием газа (только с карбонатами):
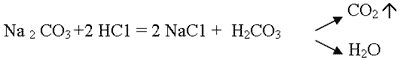
Учитель. Отметим, что угольная кислота слабая и распадается.
2. Реакция обмена с образованием осадка:
![]()
3. Реакция обмена идёт, если нерастворимое вещество растворяется:
![]()
8. Закрепление пройденного.
Докончить уравнение реакции:
NaC1 + H2SO4-->
(Реакция обмена не идёт, так как все вещества растворимы.)
9. Домашнее задание.
§ 27, упражнения 2в, 3 страница 99.