Работа подготовлена совместно с Ступиной Л.А.
Цель: познакомить учащихся с основными компонентами живых клеток – белками.
Задачи:
- Раскрыть ведущую роль белков в строении и жизнедеятельности клетки.
- Объяснить строение макромолекул белка, имеющих характер информационных биополимеров.
- Изучить химические свойства белков.
- Углубить знания учащихся о связи строения молекул веществ и их функций на примере белков.
Оборудование: таблицы: “Функции белков”, “Строение белковой молекулы”, “Структура гема”, модель структур молекул белка (можно заменить спирально закрученным эластичным телефонным шнуром или шнуром от бытового электроприбора.); реактивы: растворы NaOH, CuSO4, HNO3, химическая посуда, спиртовка, держатели.
Ход урока
1.Учитель биологии сообщает учащимся цель и задачи, план урока, настраивает их на работу.
Следующий этап – обсуждение понятия жизни, данное Ф.Энгельсом в работе “Антидюринг” и определение значения белков.
II.Учитель биологии. Белки называют также протеинами (греч. Protos – первый, главный). Этим названием выделяется первостепенное значение белков для жизненного процесса. В клетке содержится много органических соединений. После удаления воды, в сухом остатке на 1 месте по содержанию стоят белки. Они составляют 10-20% от сырой массы и 50-80% от сухой массы клетки.
Учитель химии. Многие органические соединения, входящие в состав клетки, характеризуются большими размерами молекул. Как называются такие молекулы?(макромолекулы) Они состоят обычно из повторяющихся сходных по строению низкомолекулярных соединений, связанных между собой ковалентными связями. Их строение можно сравнить с бусинками на нити. Как называются эти составные элементы? (Мономеры). Они образуют полимеры. Большинство полимеров построено из одинаковых мономеров. Такие мономеры называются регулярными. Например, если А – мономер, то –А-А-А-…….А- полимер. Полимеры, в которых мономеры различны по строению, называются нерегулярными. Например, -А-В-Р-П-А-……Г-Р-П-А-. Состав определяет их свойства. Как Вы думаете, к каким полимерам относятся белки?
Белки – нерегулярные полимеры, мономерами которых являются аминокислоты.
(Определение поясняется учителем с помощью списка аминокислот и записывается).
Учитель биологии. В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления белков пищи пищеварительными ферментами или собственных запасных белков. Природных аминокислот –150, в белки входят –20. 8 из них – незаменимые, т.е. они не способны синтезироваться в организме человека, но поступают в него с растительной пищей. Какие же это аминокислоты?
Учитель химии. Это валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин, триптофан, иногда в их число включают гистидин и аргинин. (Демонстрация таблицы).
Учитель биологии. Две последние не синтезируются в организме ребенка. Если количество этих аминокислот в пище будет недостаточным, нормальное функционирование и развитие организма человека нарушается. При отдельных заболеваниях организм человека не в состоянии синтезировать и некоторые другие аминокислоты.
Ш. Учитель химии. Каково же строение белка? Чтобы ответить на этот вопрос, давайте вспомним состояние молекулы аминокислоты в растворе?
(Один из учащихся объясняет по таблице строение биполярного иона)
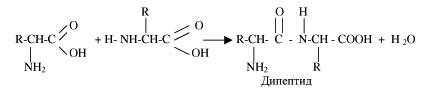
Благодаря такому строению аминокислоты способны соединяться друг с другом, образуя длинные дипептидные цепи, полипептидные молекулы.
В качестве примера давайте запишем образование дипептида – рис.1.
В состав большинства белков входят 300–500 аминокислотных остатков, но есть и более крупные белки, состоящие из 1500 и более аминокислот. Белки различаются и составом аминокислот и числом аминокислотных звеньев, и особенно порядком чередования их в полипептидных цепях. Расчет показывает, что для белка, построенного из 20 различных аминокислот, содержащего в цепи 100 аминокислотных остатков, число возможных вариантов может составить 10130. Многие белки велики и по длине, и по молекулярной массе.
Инсулин –5700
Рибонуклеаза –12700
Альбумин-36000
Гемоглобин-65000
Белки должны быть при такой массе длинными нитями. Но их макромолекулы имеют формулу компактных шаров (глобул) или вытянутых структур (фибрилл).
IV. Уровни организации белковой молекулы.
Учитель биологии. Таким образом, каждый белок имеет очень сложную структуру. Выделяют первичную, вторичную, третичную, четвертичную структуры.
Первичная структура – порядок чередования аминокислот в полипептидной цепи, определенный генотипом. (Определение записывается в тетрадь).
Представим, что перед нами полипептидная цепь (демонстрация эластичного шнура).
После растяжения шнура он вернулся в исходное состояние. Перед нами новая структура в виде спирали. Обратите внимание, на каком расстоянии находятся витки спирали? (На одинаковом).
Учитель химии. Какие силы удерживают молекулу в таком состоянии? Представьте, что наш макет перенесен на таблицу, причем здесь подробно показано химическое строение белковой молекулы. Посмотрите, на разных витках спирали оказались рядом NH и CO. Между ними образовались водородные связи. Они слабые, но их много, за счет этого обеспечивается стабильность вторичной структуры.
Вторичная структура – спираль с одинаковым расстоянием между витками.
Третичная структура – клубок из полипептидной спирали. (Демонстрация клубка из эластичного шнура).
Представить конфигурацию легко, труднее понять, какие силы ее поддерживают. (Водородные связи, дисульфидные мостики –S-S-, сложноэфирная связь между радикалами. Полярные группы COOH и OH взаимодействуют с водой, а неполярные радикалы отталкивают ее, они направлены внутрь глобул. Радикалы взаимодействуют между собой благодаря силам Ван-дер-Ваальса.)
Учитель биологии Четвертичная структура – структура из нескольких полипептидных цепей.
Демонстрация 2 шнуров, закрученных друг относительно друга.
Учитель химии. Демонстрация таблицы “Структура гема”. Пояснение строения молекул гемоглобина.
V. Начиная с вторичной структуры, пространственное строение (конфигурация) макромолекул белка поддерживается в основном слабыми химическими связями. Под влиянием внешних факторов (изменение температуры, солевого состава среды, PH и т.д.) слабые связи, стабилизирующие макромолекулу, рвутся и структура белка, а следовательно его свойства, изменяются.
Процесс утраты белковой молекулой своей структурной организации называется денатурацией. (Определение записывается в тетрадь).
Белок становится нерастворим (пример с куриным яйцом), доступен действию пищеварительных ферментов. Денатурация может быть обратимой и необратимой.
Процесс восстановления структурной организации белковой молекулы называется ренатурацией. (Определение записывается в тетрадь).
Учитель биологии. Ренатурация лежит в основе раздражимости клеток. Так под действием гормонов регулируется действие ферментов, рецепторов, транспортеров и т.д. Иногда денатурация белка имеет определенное значение. Например, паук выделяет капельку секрета и приклеивает ее к какой-нибудь опоре. Затем, продолжая выделять секрет, он слегка натягивает ниточку и этого слабого натяжения достаточно, чтобы белок денатурировался, из растворимой формы перешел в нерастворимую, и нить приобрела прочность.
Учитель химии. Мы рассмотрели одно из основных свойств белков, имеющее глубокий биологический смысл.
Свойства белков (демонстрация опытов, записи в тетрадях).
Для белков характерны реакции с выпадением осадков. В одних случаях полученный осадок при избытке воды вновь растворяется (т.е. происходит ренатурация). Это возможно, если на белок было оказано воздействие слабым раствором спирта, кислоты, солями легких металлов.
Разберем цветные реакции белков.
1. Биуретовая реакция (на обнаружение группы –CONH–). Если к небольшому количеству раствора белка прилить немного NaOH и по каплям добавлять раствор СuSO4, то появляется красно-фиолетовая окраска.
2. Ксантопротеиновая реакция (на бензольные кольца, содержащиеся в некоторых аминокослотах). Под действием концентрированной HNO3 белки окрашиваются в желтый цвет.
3. Реакция с ацетатом свинца (CH3COO)2Pb или Pb(OOCCH3)2. Если к раствору белка прилить раствор ацетата свинца, а затем NaOH и нагреть, то выпадает черный осадок, что указывает на содержание серы.
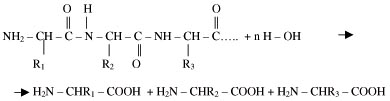
4. Гидролиз белков (раствор кислоты, щелочи, нагревание). – Рис. 2
VI. Пищевая ценность белков.
Учитель биологии. Так белки проявляют себя при химических реакциях. Так их можно обнаружить. Какова же ценность белков для организма человека?
Сообщение учащегося или учителя биологии. Белок – важный компонент пищи человека. Основные источники пищевого белка: мясо, молоко, продукты переработки зерна, хлеб, рыба, овощи. Напомним Вам, что потребность в белке зависит от возраста, пола, вида деятельности. В организме здорового человека должен быть баланс между количеством поступающих белков и выделяющимися продуктами распада. Для оценки белкового обмена введено понятие белкового баланса. В зрелом возрасте у здорового человека существует азотное равновесие, т.е. количество азота, полученного с белками пищи равно количеству выделяемого азота. В молодом, растущем организме идет накопление белковой массы, поэтому азотный баланс будет положительный, т.е. количество поступающего азота превышает количество выводимого из организма. У людей пожилого возраста, а также при некоторых заболеваниях наблюдается отрицательный азотный баланс. Длительный отрицательный азотный баланс ведет к гибели организма.
Необходимо помнить, что некоторые аминокислоты при тепловой обработке, длительном хранении продуктов могут образовывать неусвояемые организмом соединения, т.е. становиться “недоступными”. Это снижает ценность белка.
Животные и растительные белки усваиваются организмом неодинаково. Если белки молока, молочных продуктов, яиц усваиваются на 96%, мяса и рыбы – на 93–95%, то белки хлеба – на 62–86%, овощей – на 80%, картофеля и некоторых бобовых – на 70%. Однако смесь этих продуктов может быть биологически более полноценной.
На степень усвоения организмом белков оказывает влияние технология получения пищевых продуктов и их кулинарная обработка. При умеренном нагревании пищевых продуктов, особенно растительного происхождения, усвояемость белков несколько возрастает. При интенсивной тепловой обработке усвояемость снижается.
Суточная потребность взрослого человека в белке разного вида 1–1,5 г на 1 кг массы тела, т.е. приблизительно 85–100 г. Доля животных белков должна составлять приблизительно 55% от общего его количества в рационе.
VII. Какие же функции выполняют белки? (Таблица “Функции белков”).
1. Белки участвуют в образовании всех мембранных и немембранных структур клетки, а также внеклеточных структур. У высших животных, например, из белков состоят стенки кровеносных сосудов, сухожилия, хрящи и т.д. Поэтому первая функция строительная (кератин, коллаген).
2. В каждой живой клетке непрерывно происходят сотни биохимических реакций. От чего зависит скорость химических реакций? (От свойств реагирующих веществ, от их концентрации, от температуры). Химическая активность веществ в клетке небольшая, концентрации незначительны, температура клеточной среды невысокая, т.е. реакции в клетке должны протекать медленно. Но это не так. Почему? Подобные результаты достигаются благодаря наличию катализаторов. Клеточные катализаторы называются ферментами. Они ускоряют реакции в миллионы раз. По химической природе почти все ферменты – белки. В последние годы стало известно, что некоторые молекулы РНК имеют свойства ферментов. Представление о том, что ферменты – белки, утвердилось не сразу. Для этого нужно было научиться выделять их в высокоочищенной кристаллической форме. Впервые это сделал Самнер в 1926 году, выделив уреазу – фермент, расщепляющий мочевину. Потребовалось еще 10 лет, в течение которых были получены несколько ферментов в кристаллической форме, чтобы представление о белковой природе этих веществ стало доказанным и получило всеобщее признание.
Каждая молекула фермента способна осуществить от нескольких тысяч до нескольких миллионов операций в минуту. Известно более 2000 ферментов и количество их продолжает увеличиваться. Каталитическая активность характеризуется определенным участком – активным центром. Благодаря определенной пространственной структуре молекулы белка и определенному расположению аминокислот в нем фермент узнает свой субстрат, присоединяет его и ускоряет его превращение. В белковой молекуле есть участки, которые узнают еще и конечный продукт, сходящий с биологического конвейера. Если такого продукта слишком много, то активность самого начального фермента тормозится им, и наоборот, если продукта слишком мало, то фермент активируется. Это обратные связи, которые обеспечивают процессы саморегуляции. Такие принципы лежат в основе современной техники, в создании автоматических устройств. Подобные же принципы используются во многих природных механизмах, в живой клетке. Таким образом, 2 функция – каталитическая.
1. Кроме 2 названных, важна сигнальная функция. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
2. Движение, как известно, одно из проявлений жизненной активности. Все виды движений, к которым способны клетки у высших животных, в том числе и сокращение мышц, а также мерцание ресничек, движения жгутиков выполняют особые сократительные белки (актин, миозин и др.). 4 функция – двигательная.
3. В крови, в наружных клеточных мембранах, в цитоплазме, ядре клетки есть различные транспортные белки. Так белок крови гемоглобин присоединяет кислород и разносит его по всем тканям и органам.
4. Большое значение имеет защитная функция белков. При введении чужеродных белков или клеток в организм в нем происходит выработка особых белков, которые связывают и обезвреживают чужеродные клетки и вещества. В лимфоидных тканях (лимфатические железы, селезенка, вилочковая железа) производятся клетки-лимфоциты, способные синтезировать огромное разнообразие защитных белков антител. Такие антитела носят название иммуноглобулинов. Их молекулы имеют участок, узнающий “пришельца” и участок осуществляющий “расправу” с ним. Самое удивительное то, что лимфоциты способны ответить синтезом соответствующих антител на любой антиген, с которым клетка и организм даже никогда не встречались. В клетках человека и животных синтезируются также специальные противовирусные белки – интерфероны. Синтез таких белков начинается после встречи клетки с вирусной нуклеиновой кислотой. Он блокирует аппарат синтеза вирусных белков.
5. Регуляторная функция связана с регуляторами физиологических процессов – гормонами. Многие из них также по природе своей белки. Гормоны роста, адренокортикотропный, тиреотропный гормоны, инсулин, глюкагон и другие являются белками. Успехи в области генной инженерии привели к тому, что многие из числа гормонов-белков производятся уже в больших количествах как исключительно важные лекарственные средства. Для лечения больных сахарным диабетом получают инсулин из поджелудочной железы животных. Поскольку бычий инсулин несколько отличается по первичной структуре от человеческого, то не все больные переносят его. Синтез человеческого инсулина генно-инженерными методами открыл новые возможности для лечения таких больных.
7. Еще одна функция белков, вытекающая из анализа уровней структурной организации белков – энергетическая. При распаде 1 г белка до конечных продуктов выделяется около 17 кДж энергии. Однако белки используются, как источник энергии обычно, когда истощаются иные источники, такие как углеводы и жиры. Таким образом, мы рассмотрели значение белков, некоторые их функции.
VIII. Итак, мы познакомились сегодня со значением белков для клетки, организма человека в целом, поговорили о химических свойствах и биологических функциях белков. Давайте вспомним наиболее важные понятия и термины этой темы. Придумайте соответствующие вопросы к терминам на доске:
1. Протеины.
2. Пептидная связь.
3.Незаменимые аминокислоты.
4. Первичная структура белка.
5. Вторичная структура белка.
6. Третичная структура белка.
7. Четвертичная структура белка.
8. Белки.
9. Денатурация.
10. Ренатурация.
Учащиеся работают в парах.