Форма урока: комбинированный (2 часа).
Цели:
- Образовательные: на основе представлений о составе и строении фенола рассмотреть химические свойства; дать представление о химии полимеров и реакции поликонденсации; охарактеризовать связь химии с жизнью.
- Развивающие: совершенствовать умение сравнивать, обобщать, делать выводы о свойствах веществ на основе строения и о строении веществ по их свойствам, применять знания для составления прогнозов и объяснений, развивать умение применять приобретенные знания в нестандартных ситуациях.
- Воспитательные: развивать умение работать в парах и малых группах, прислушиваться к мнению друзей, обратить внимание на применимость закона диалектики о переходе количественных изменений в качественные.
Оборудование: мультимедийная установка, шаростержневые модели бензола, этилового спирта, презентация “Химические свойства фенола”.
На ученических столах: коллекция изделий на основе фенолформадегильной смолы, FeCl3, чайная заварка.
Ход урока
1. Организационный момент.
2. Актуализация опорных знаний и мотивация познавательной деятельности.
Учитель: Предлагает ответить на вопросы (Слайды: 1, 2) и наводит на определение темы и целей урока.
- Какие вещества называются фенолами?
- По числу гидроксогрупп какие различают фенолы?
Учитель: В основе учения об органических веществах лежит теория химического строения А.М.Бутлерова. Объясните почему?
(Ответ: Эта теория раскрывает взаимосвязь между строением веществ и их свойствами, показывает, что свойства веществ неслучайные).
Из каких двух знакомых фрагментов состоит молекула фенола?
Сформулируйте 3 положение теории А.М.Бутлерова.
3. Определение темы урока, целей и задач урока.
Учитель задаёт вопрос: Как вы считаете, какой будет тема урока?
(Ученики высказывают версии, формулируют с помощью учителя тему урока.
Записывают тему урока в тетрадь). Слайд 3.
4. Изучение нового материала.
Учитель: Свойствами каких соединений формально должен обладать фенол?
(Ответ: фенол должен сочетать свойства аренов (бензола) и одноатомных спиртов).
Учитель: Оказывается, это не совсем так.
Именно поэтому фенолы рассматриваются отдельно от класса спиртов.
Учитель: Как Вы думает, в чем причина?
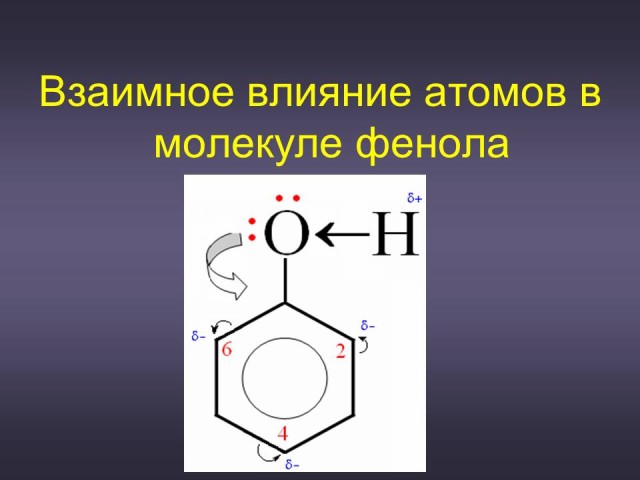
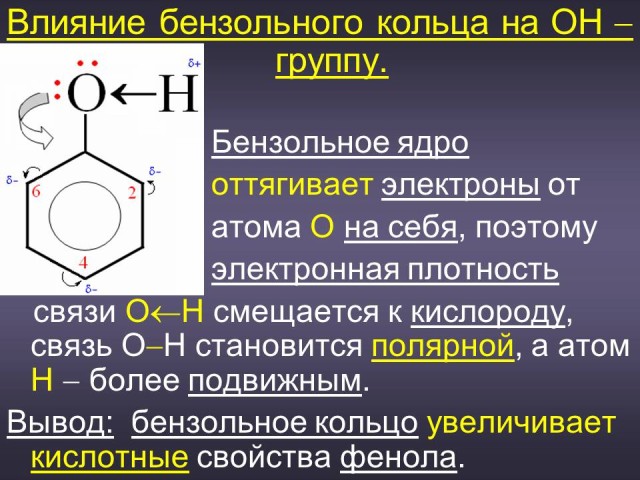
(Ответ: причина кроется в том, что в результате взаимного влияния гидроксильной группы и ароматического радикала химические свойства этих фрагментов изменяются, а фенол в целом приобретает некоторые особенные свойства). (Слайд: 7).
4.1. Кислотные свойства фенола.
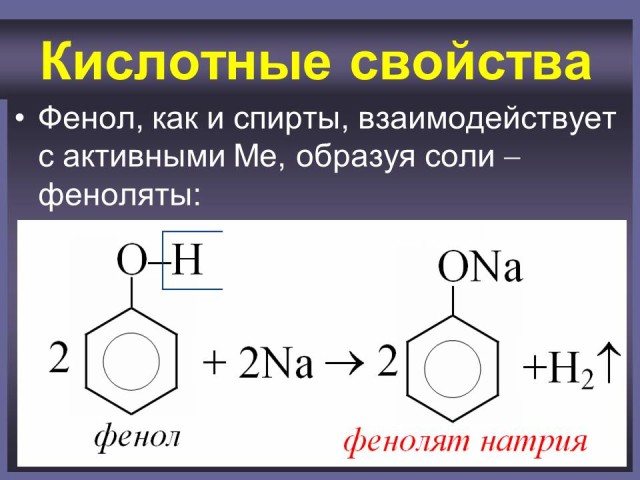
Ученики предполагают, что для фенола характерна реакция с Ме (IА). (Слайды: 8, 9).
2 C6H5OH +2 Na —> 2 C6H5ONa + H2
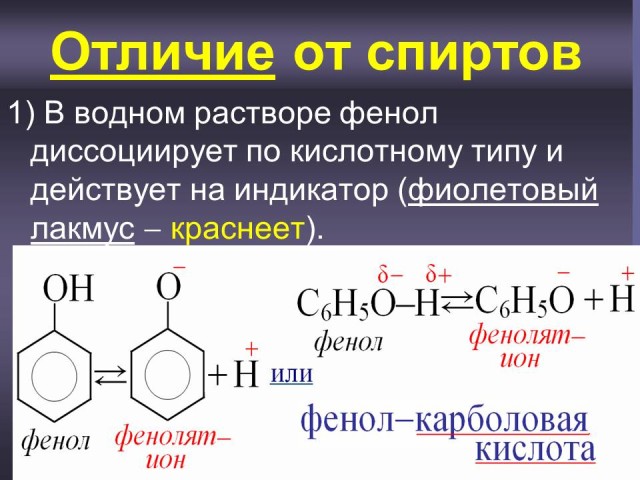
Учитель: первым доказательством более сильных кислотных свойств фенола по сравнению со спиртами является тот факт, что в водном растворе наблюдается незначительная диссоциация фенола: C6H5OHFC6H5O– + H+. (Слайд: 10).
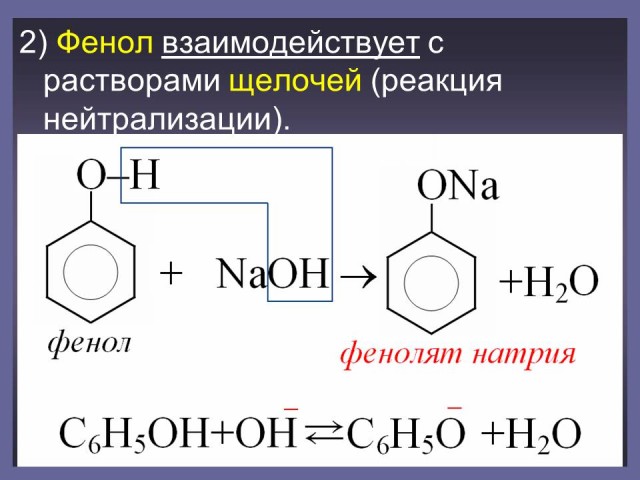
В отличие от спиртов фенол взаимодействует с щелочами.
C6H5OH + NaOH
C6H5ONa + H2O
Реакция обратима, т.к. фенолят натрия - это соль, образованная слабой кислотой и сильным основанием. (Слайд: 11, 12).
Вопрос: что происходит с солями в водном растворе? Какова реакция среды в растворе фенолята натрия? (Ответ: они гидролизуются; среда щелочная). (Слайд: 13).
Учитель: первым названием фенола было карболовая кислота. Однако кислота эта значительно слабее не только сильных, но даже некоторых неорганических кислот, даже угольной:
C6H5ONa + CO2 +H2O —> C6H5OH
+NaHCO3.
Отличие от спиртов: (Слайд: 14).
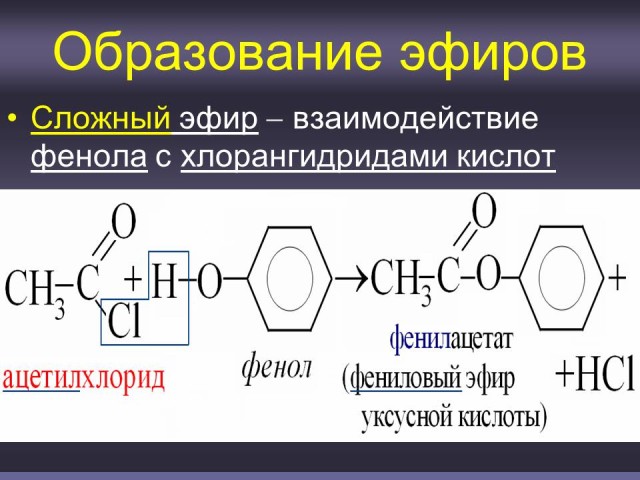
- Фенол не образует сложных эфиров при действии на него карбоновых кислот.
- Фенол не образует простых эфиров при действии конц. серной кислоты.
- Фенол не реагирует с галогеноводородами.
Вопрос: Чем обусловлено различие кислотных свойств спиртов и фенола?
(Ответ: различие кислотных свойств спиртов и фенола обусловлено влиянием радикала на гидроксильную группу: радикал фенил - C6H5 увеличивает подвижность атома водорода в ОН группе, а алкильные радикалы (- СН3, - C2H5) уменьшают ее, поэтому кислотные свойства у фенола выражены сильнее, чем у спиртов. (Слайд: 15).
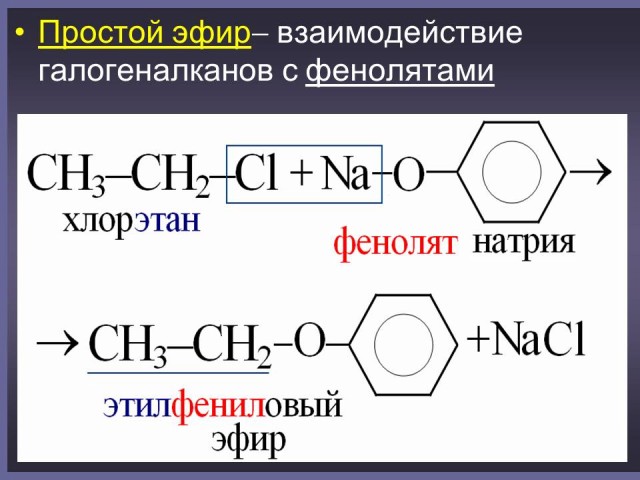
Вопрос: как можно получить сложные и простые эфиры?
Ученики высказывают свои предположения. Затем идет объяснение.
Учитель: в отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот, для этого можно использовать хлорангидриды кислот. H3CC(O)Cl+HO–C6H5 —> H3C–C(O)–O–C6H5+HCl (Слайд: 16).
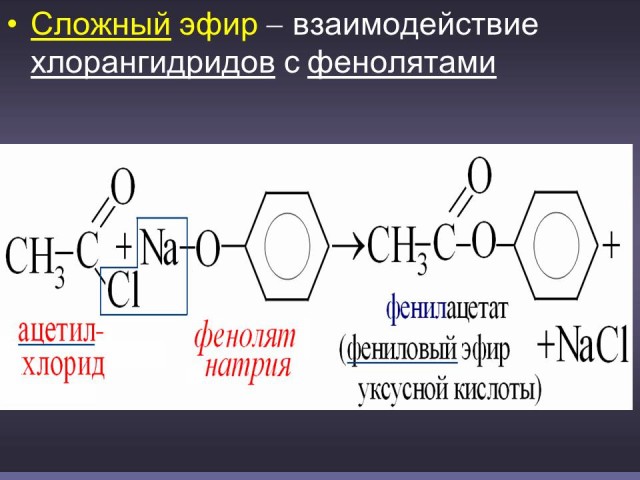
В качестве исходных веществ для получения простых и сложных эфиров используются также феноляты. (Слайды: 17, 18).
Затем ученики составляют уравнения возможных реакций получения эфиров. (Слайд: 19). (На усмотрение учителя данное упражнение может быть выполнено учениками в качестве домашнего задания).
4.2. Реакции электрофильного замещения.
Учитель: Почему реакции электрофильного замещения в бензольном кольце фенола протекают легче, чем у бензола, и в более мягких условиях? (Слайд: 20).
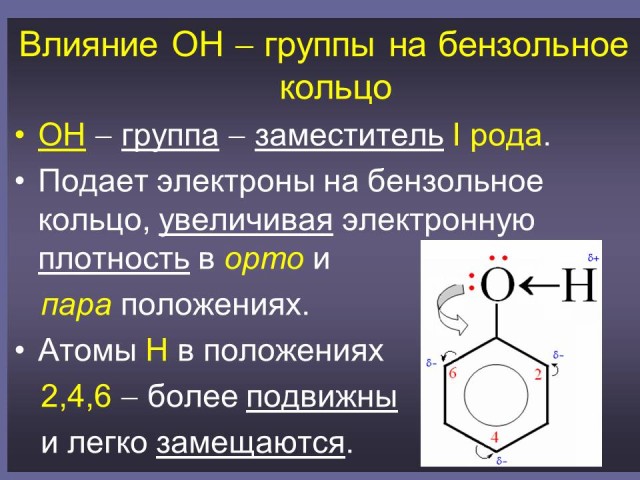
Ответ: Влияние ОН - группы на бензольное кольцо
ОН - группа - заместитель I рода.
Подает электроны на бензольное кольцо, увеличивая электронную плотность в орто и пара положениях.Атомы Н в положениях 2,4,6 - более подвижны и легко замещаются. (Слайд: 21).
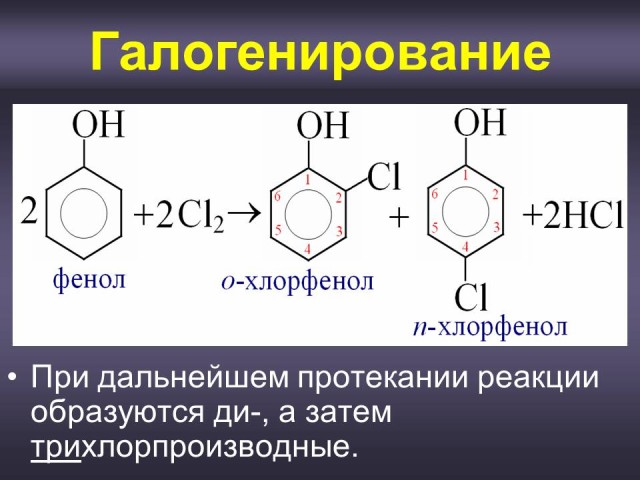
Хлорирование (Слайд: 22).

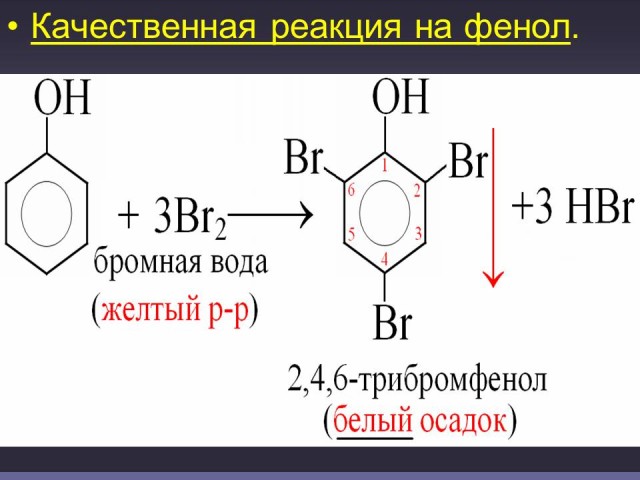
Реакция с бромной водой- качественная реакция. (Слайд: 23, 24).

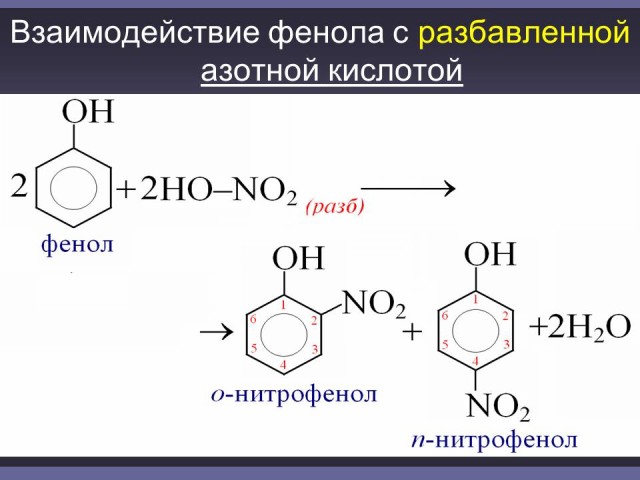
Аналогичные закономерности наблюдаются при нитровании фенола. Однако при действии на фенол разбавленной азотной кислотой можно получить смесь монозамещенных нитропроизводных: о-нитрофенола и п-нитрофенола. (Слайд: 25).
Ученик у доски записывает реакцию взаимодействия фенола с разбавленной HNO3. Проверка - (Слайд: 26).

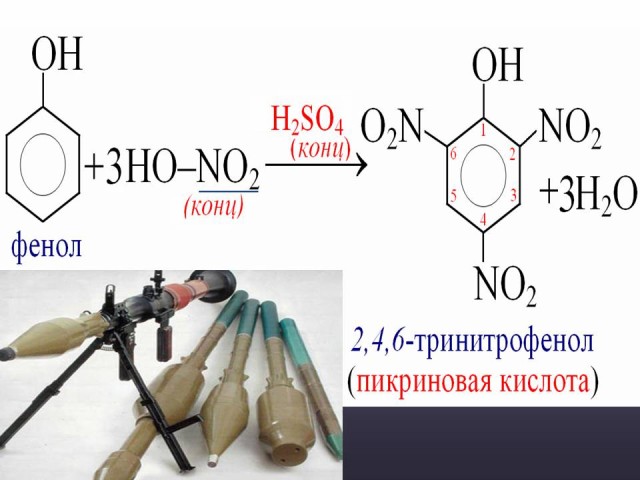
При взаимодействии с концентрированной азотной кислотой образуется 2,4,6-тринитрофенол. Ученик у доски записывает реакцию взаимодействия фенола с концентрированной HNO3. Проверка - (Слайд: 27).
Электроноакцепторные свойства нитрогрупп значительно усиливают кислотность тринитрофенола. Он является примерно в миллиард раз более сильной кислотой по сравнению с фенолом, и в 100 раз сильнее фосфорной кислоты. (Слайд: 28).

Рассказ учителя. Впервые тринитрофенол получил в 1771г. английский химик П.Вульф действием азотной кислоты на природное органическое вещество индиго. Благодаря интенсивной желтой окраске вещества его стали использовать в качестве красителя для волокна и тканей. Из-за горького вкуса тринитрофенол назвали сначала пикрином (от греческого слова pykros - горький, острый), а затем - пикриновой кислотой. В 1779г. выяснилось, что это вещество способно взрываться. Но только после того, как на нескольких красильных фабриках произошли несчастные случаи в результате взрывов пикриновой кислоты, она в 1885г. была запатентована в качестве взрывчатого вещества.
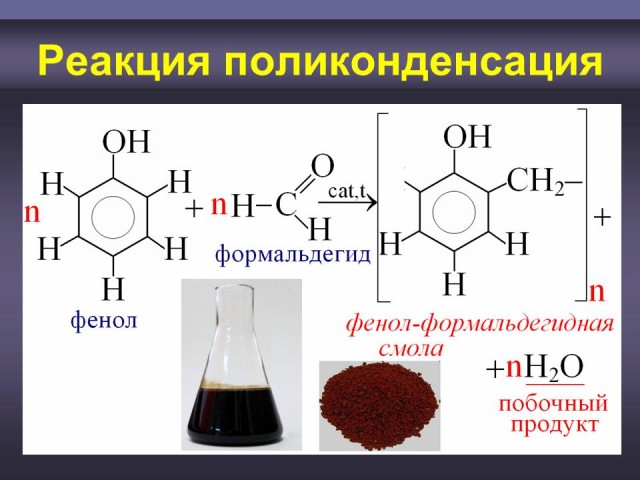
4.3. Реакция поликонденсация.
Объяснение.
Одним из важнейших свойств фенола, используемых в промышленности, является его способность вступать в реакцию с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, в ходе которой образуется реакция поликонденсации, в ходе которой образуется высокомолекулярное соединение - фенолформальдегидная смола и выделяется низкомолекулярный продукт вода. (Слайд: 29, 30, 31, 32). Из фенолформальдегидной смолы получают пластмассы - фенопласты (бакелиты). Фенопласты - важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливается большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали. Сравнение с реакцией полимеризацией. Закрепление понятий “полимер”, “мономер”, “структурное звено”, “степень полимеризации”, “степень поликонденсации”.
Работа с коллекцией изделий на основе фенолформадегильной смолы.
4.5. Взаимодействие с раствором хлорида железа (III).
Качественной реакцией на фенол и его гомологи является образование окрашенных комплексов с раствором хлорида железа (III). (Слайд 33, 34).
В экстрактах многих растений, особенно обладающих дубильным и вяжущим действием, содержатся вещества, называемые “танины”. В состав их молекул входит большое число фенольных остатков. Они также дают с хлорным железом интенсивное окрашивание. Ученики проводят опыт: в пробирку наливают 2-3 мл холодной чайной заварки светло-желтого цвета и добавляют 2-3 капли раствора хлорида железа (III). Жидкость приобретает чернильный цвет. В чайных листах содержится большое количество танина, придающего напитку терпкий вяжущий привкус.
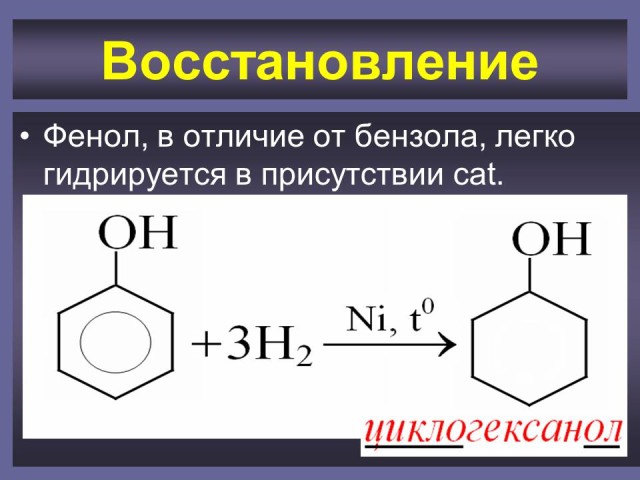
4.6. Восстановление.
Ученик у доски записывает реакцию взаимодействия фенола с водородом. Проверка - (Слайд 35).
4.7. Окисление.
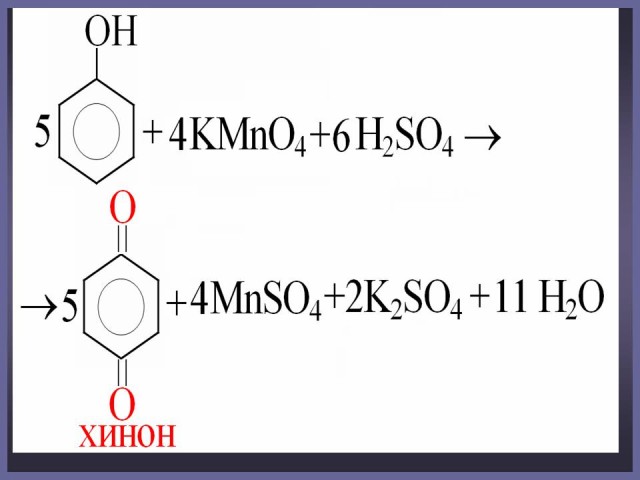
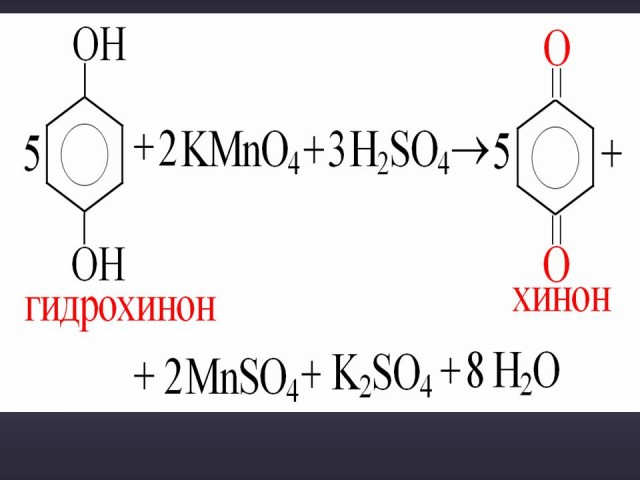
Объяснение: фенолы легко окисляются даже под действием кислорода воздуха. На воздухе фенол постепенно окрашивается в розовато-красный цвет. При окислении фенола сильными окислителями основным продуктом окисления является хинон. Двухатомные фенолы окисляются легче. При окислении гидрохинона также образуется хинон.
(Слайд 36).
Окисление фенола и гидрохинона. (Слайд 37, 38). На усмотрение учителя данный материал может быть рассмотрен на элективных курсах при подготовке к ЕГЭ.
5. Заключительная часть.
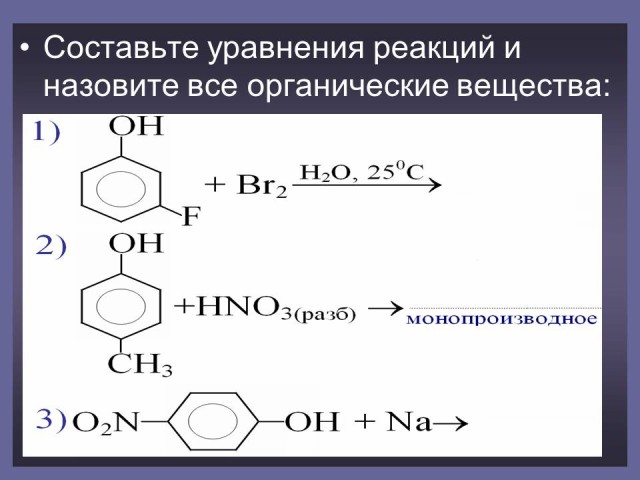
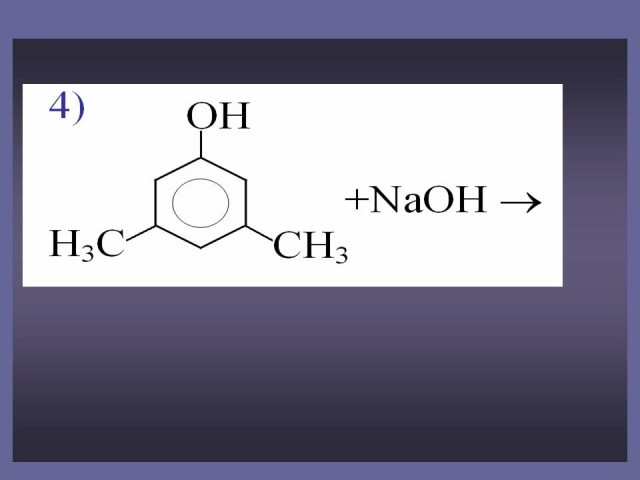
Задания для закрепления материала и развития логического мышления. (Слайд 39-41).
6. Подведение итогов урока. Рефлексия.
Учитель предлагает ученикам определить результаты урока, сравнить их с целями.
7. (Слайд 42). Домашнее задание.
Параграф 18 по учебнику О.С.Габриелян, И.Г.Остроумов, С.Ю.Пономарев. Химия. 10 класс (М. Дрофа, 2014); стр. 193 № 1-10.
8. Отметки за урок. (Слайд 43).
9. Список используемой литературы. (Слайд 44).
- О.С.Габриелян, И.Г.Остроумов. Настольная книга учителя химии. 10 класс. М. 2001 “Блик и К0”
- Н.Е. Дерябина. Органическая химия. Книга 1. Углеводороды и их монофункциональные производные. М. 2012.
- Единая коллекция цифровых образовательных ресурсов. http://school-collection.edu.ru
- Органическая химия. Видеоопыты: взаимодействие фенола с натрием, взаимодействие фенола с гидроксидом натрия, взаимодействие фенола с бромной водой, взаимодействие фенола с хлоридом железа (III).
- Интернет-ресурсы.