Цели. Сформулировать общее представление об элементе железо и о простом веществе железо, закрепить знания о химических свойствах металлов и переходных элементах.
Задачи урока.
Образовательные: Составить полное представление об элементе и простом веществе – железе, о его физических свойствах, опираясь на знания зависимости свойств металлов от строения их атомов; предсказать характерные химические свойства железа; сформировать понятия о составе и свойствах оксидов и гидроксидов железа; познакомить учащихся с качественными реакциями на катионы железа (двух- и трехзарядные).
Развивающие: на основе межпредметных связей продолжить формирование умений устанавливать взаимосвязь между составом, строением и свойствами веществ; познакомить учащихся с качественными реакциями, способствовать развитию исследовательских навыков; развивать у учащихся представления о познаваемости и единстве окружающего нас мира в результате предоставления информации о разных формах существования железа и его нахождении в природе; продолжить формирование умений работать быстро, экономя время урока.
Воспитательные: формировать воспитывать культуру учебного труда, аккуратность, внимание при проведении эксперимента, совершенствовать технику безопасного труда.
Оборудование и реактивы. карточки “Физические свойства железа”, карточки для закрепления учебного материала; тесты “Алюминий”, “Железо”.
| Учебный элемент | Содержание работы | Деятельность ученика и источник информации | ||||||||||||||||||||||||||||||
| УЭ–0 | Цель урока. Проверить знания строения атома алюминия и его физических и химических свойствах. Составить полное представление об элементе и простом веществе – железе, о его физических свойствах, опираясь на знания зависимости свойств металлов от строения их атомов; характерные химические свойства железа. | |||||||||||||||||||||||||||||||
| УЭ–1 | Проверка домашнего задания. | Получите у учителя карточку с тестом и выполните задание. Сдайте на проверку тетрадь с дополнительным заданием, полученным на предыдущем уроке (по желанию ученика). | ||||||||||||||||||||||||||||||
| УЭ–2
|
Лекция учителя. План работы. I. Строение и свойства атома
II. Железо простое вещество. 1) Физические свойства
2) Получение железа
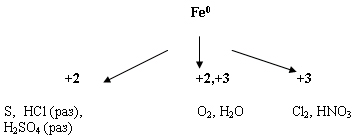
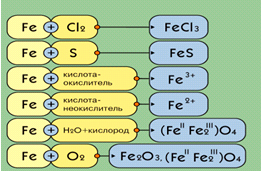
3) Химические свойства Fe.
4) Нахождение Fe в природе.
5) Применение Fe.
|
Просмотр презентации “Железо”. Прочитай материал на стр. 76 учебника и выполни следующие задания: 1. Выпишите в тетрадь положение Fe в периодической системе. - № группы, подгруппа. - № периода - № порядковый, заряд ядра 2. Составьте электронную и графическую формулу строения атома Fe. 3. Выпишите степени окисления Fe: С.О- Внимательно прочитайте материал на стр. 76. Заполните таблицу.
Прочитайте материал стр. 77 и используя дополнительный материал изучите основные способы получения Fe. Допишите уравнения реакции. Fe2O3 + Al = ? Fe3O4 + 4CO = 3Fe + 4CO2 FeO + C = Fe + CO Внимательно прочитайте материал на стр. 77 –78 учебника и дополнительный материал. 1) запишите в тетрадь схему степеней окисления Fе.
2) Допишите уравнения реакции расставьте
коэффициенты. (Разобрать уравнение с окислительно-восстановительной точки зрения)
Используя материал учебника стр. 78 и дополнительный материал выпишите формулы основных минералов железа. Руды.
Лимонит -
Заполнить таблицу используя материал учебника. Стр. 79-81.
|
||||||||||||||||||||||||||||||
| УЭ–3 | Закрепление изученного материала. | Выполните тест (желательно без
учебника). 1. Сколько d электронов содержит атом железа? 1) 26; 2) 8; 3) 6; 4) 56. 2. При взаимодействии железа с раствором соляной кислоты образуется соль состава: 1) FeCl3 2) FeCl2 3. Железо в природе встречается: 1) преимущественно в виде оксидов; 2) исключительно в самородном виде; 3) в виде галогенидов; 4) только в виде карбонатов. 4. Какие из указанных металлов являются более активными, чем железо? 1) Cu; 2) Ca; 3) Hg; 4) K. 5. Атом железа имеет следующую электронную конфигурацию внешнего слоя: 1) 3p64s2 2) 3p63d3 3) 3d64s2 4) 3p63d04s1 |
||||||||||||||||||||||||||||||
| УЭ–4 | Итог урока. Положение Fe в ПС |
Д.З.Параграф 14, Упр 4 Дополнительное задание.Подготовить сообщение на темы Биологическая роль железа, производство железа |
||||||||||||||||||||||||||||||
Тест (Приложение)