Все мы знаем, что ребята, впервые пришедшие в кабинет химии, в большинстве своем проявляют повышенный интерес к химии, связанный с проведением ярких, впечатляющих опытов на уроках. Но, к сожалению, этот интерес у многих пропадает уже к третьей-четвертой четверти 8-го класса. Значит, необходимо приложить все усилия к тому, чтобы у детей не только не пропал интерес к предмету, а, наоборот, увеличилось число заинтересованных учащихся. Помочь развить интерес к предмету могут нетрадиционные уроки-игры и внеклассные мероприятия. Игру не зря называют королевой детства, при умелом использовании она может стать незаменимым помощником педагога.
Данный урок-КВН можно проводить и в учебные часы, между, например, мальчиками и девочками одного класса, так и как внеклассное мероприятие, как соревнование между командами разных классов. Команды придумывают название, девиз, эмблему и в качестве домашнего задания рисуют стенгазеты на заданные темы, например: “Круговорот азота и фосфора в природе”, “История открытия элементов VА группы”, “Применение элементов VА группы”. Альтернатива – доклады-сообщения или программы-презентации с использованием Интернет-ресурсов. Первый этап КВНа – это оценивание домашнего задания команд.
Тип урока – обобщающий.
Цель: обобщить знания обучающихся о свойствах элементов VА группы, их роли в природе и жизни человека; подготовить обучающихся к проведению контрольной работы по данной теме.
Задачи.
I. Образовательные.
- Выявление, корректировка и обобщение знаний обучающихся об азоте и фосфоре как об элементах и простых веществах, их нахождении в природе, физических и химических свойствах, способах получения и применения.
- Закрепление и углубление знаний обучающихся о соединениях элементов VА группы, их составе и способах получения.
- Закрепление и расширение знаний о связи химии с практической жизнью.
II. Воспитательные.
- Воспитание чувства коллективизма, ответственности перед коллективом за выполняемую работу.
- Экологическое воспитание на основе знаний о круговоротах азота и фосфора в природе, их значении для жизни на Земле.
- Формирование у обучающихся научного мировоззрения.
III. Развивающие.
- Развитие познавательного интереса к химии.
- Развитие логического мышления обучающихся на примерах сравнения, анализа, умений находить и исправлять ошибки, обобщать, делать выводы.
- Развитие речи, памяти, внимания, воображения.
Оформление кабинета:
- Таблицы и плакаты по теме “Элементы VА группы”:
- Круговороты азота и фосфора в природе.
- Промышленный синтез аммиака.
- Применение аммиака.
- Минеральные удобрения.
- Модель промышленной установки синтеза аммиака.
- Оборудование к конкурсу “Бабушкина лаборатория”.
- Оборудование к опыту “Вулкан на столе”.
Межпредметные связи:
- С географией – нахождение элементов VА группы и их соединений в природе.
- С биологией – биологическая роль азота и фосфора.
- С экологией – круговороты азота и фосфора в природе, их значение для жизни на Земле; способы повышения плодородия почвы.
- С историей – история открытия и применения элементов VА группы и их соединений.
ПЛАН ПРОВЕДЕНИЯ КВНа
План вывешивается на листе ватмана или пишется на доске для отражения хода КВНа - выставления количества баллов, набранных командами.
- Домашнее задание – конкурс стенгазет.
- Разминка – кроссворд.
- Исторический конкурс.
- Конкурс капитанов.
- “Бабушкина лаборатория”.
- Химическое домино.
- Экологический лабиринт.
ХОД КВНа
1. Объявление темы, цели и задач КВНа. Знакомство с жюри (учителя химии других школ или учащиеся старших классов, члены химического кружка). Представление команд, оценивание их домашнего задания.
2. Разминка
Каждая команда получает листы-сетки кроссворда и вопросы к нему. На отгадывание кроссворда выделяется 3 или 5 минут. Число баллов равно числу разгаданных слов.
КРОССВОРД по теме “Элементы VА группы Периодической таблицы”
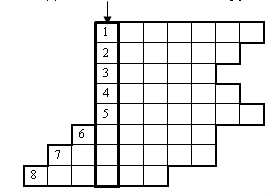
Вводное слово – Бытовое название хлорида аммония, который применяется при паянии.
- Соли азотной кислоты.
- Природное соединение фосфора, большие запасы которого залегают на Кольском полуострове.
- Шведский химик, выделивший азот из “сгоревшего воздуха” в 1770 году.
- Важнейший продукт химической промышленности, основа для производства азотных удобрений.
- Отрасль промышленности, выпускающая минеральные удобрения.
- Элемент VА группы, название которого состоит из названий двух животных.
- Советский академик, геохимик, назвавший фосфор “элементом жизни и мысли”.
- Металлический элемент VА группы.
ОТВЕТЫ:
Вводное слово – НАШАТЫРЬ
По горизонтали: 1. Нитраты; 2. Апатит; 3. Шееле; 4. Аммиак; 5. Туковая; 6. Мышьяк; 7. Ферсман; 8. Сурьма.
3. Исторический конкурс
Проводится по типу телевизионной программы “Своя игра” с использованием программы-презентации Microsoft Power Point. Команды выбирают вопросы из таблицы, имеющие разную “стоимость” в баллах. <Приложение1>
|
Цена вопроса |
||
|
А1 - 3 балла |
А2 - 5 баллов |
А3 - 8 баллов |
|
Б1 - 3 балла |
Б2 - 5 баллов |
Б3 - 8 баллов |
|
В1 - 3 балла |
В2 - 5 баллов |
В3 - 8 баллов |
А1 |
Это соединение азота обладает своеобразным физиологическим действием. Выдающийся английский химик Хэмфри Дэви с его помощью устраивал специальные сеансы. Вот как описывал действие этого соединения один из современников Дэви: “Одни джентльмены прыгала по столам и стульям, у других развязались языки, третьи обнаружили чрезвычайную склонность к потасовке”. В настоящее время это соединение используется в медицине, например, для снятия боли при инфаркте миокарда. О каком соединении азота идет речь? Какова его химическая формула? |
А2 |
В 1824 английский священник Томас Мальтус провозгласил свою известную доктрину о том, что народонаселение растет гораздо быстрее, чем производство продуктов питания. В 1887 году соотечественник Мальтуса, известный ученый Томас Гексли предсказал скорый конец цивилизации из-за грозящего голода. Через 11 лет еще один знаменитый ученый сэр Уильям Крукс заявил в Британском обществе содействия наукам, что не пройдет и полувека, как наступит продовольственный крах, если численность народонаселения не сократится. Чем аргументировали ученые свои печальные прогнозы? Почему они не оправдались? |
А3 |
Выдающийся писатель-сатирик Джонатан Свифт охотно издевался над бесплодием современной ему науки. В “Путешествиях Гулливера”, в описании академии Лагадо, есть такое место: “В его распоряжении были две большие комнаты, загроможденные самыми удивительными диковинами; пятьдесят помощников работали под его руководством. Одни сгущали воздух в сухое плотное вещество, извлекая из него это удобрение …”. Какое минеральное удобрение упоминается в данном отрывке? Возможно ли его получение из воздуха и воды в современных условиях? Если да, то на основе каких химических реакций? |
Б1 |
В 1934 году американский физик П. Бриджмен при давлении примерно 12 • 108 Па и 200°С получил самую устойчивую форму фосфора. Эта модификация по внешнему виду и физическим свойствам похожа на графит: серого цвета, имеет металлический блеск, обладает металлической электропроводностью, твердостью и теплопроводностью, низкой химической активностью. О какой аллотропной модификации фосфора идет речь? Чем объясняется ее сходство с графитом? |
Б2 |
Свое название “обманщик” (греч.) данный минерал получил за странный и разнообразный вид: “…то это прозрачные кристаллики, до мелочей напоминающие берилл или даже кварц, то это плотные массы, неотличимые от простого известняка, то это радиально-лучистые шары, то порода зернистая и блестящая, как крупный мрамор” (“Занимательная минералогия”, 1937). Огромные запасы этого минерала были открыты академиком А. Е. Ферсманом и его сотрудниками на Кольском полуострове в 1926 году. О каком минерале фосфора идет речь? Каков его химический состав? |
Б3 |
О существовании этих кислородсодержащих соединений фосфора с максимальной степенью окисления, о последовательности перехода одних форм в другие, о механизме превращений велись споры в течение более ста лет – с первой половины XIX века. Тогда И. Берцелиусом бело замечено, что соединение фосфора, полученное из его оксида, обладает разными свойствами в зависимости от способа получения. В 1833 г. Т. Грэхем открыл третье подобное соединение. Теоретические предпосылки объяснения данного явления были разработаны лишь в сороковых годах XX века советскими исследователями во главе с профессором Ю. В. Ходаковым. О каких соединениях фосфора идет речь? Каким образом возможны переходы из одной формы в другую? |
В1 |
Алхимические символы каких элементов изображались в виде извивающейся змеи и хищного волка с раскрытой пастью? Почему? |
В2 |
Какое соединение элемента VА группы используется в стоматологической практике для умерщвления зубного нерва? |
В3 |
Русское название этого элемента произошло от турецкого слова, обозначающего “натирание”, “чернение”, так как некое бинарное соединение этого элемента VА группы использовалось женщинами более 50 веков назад для чернения бровей и подводки глаз. Назовите элемент и его упоминающееся соединение. |
ОТВЕТЫ
А1 |
Данное соединение – оксид азота (I) N2O, известный под названием “веселящий газ”. |
А2 |
Еще в XVII веке немецкий химик И.
Р. Глаубер отмечал важность азотных солей для
развития растений, называя селитру “солью
плодородия”. В XIX века почти единственным
источником природной селитры было чилийское
месторождение. Поэтому и предрекали Т. Гексли и У.
Крукс скорый конец цивилизации из-за “азотного
голода”, который должен был наступить после
выработки этого месторождения. Пророчества эти
не оправдались, так как человечество освоило
искусственную фиксацию азота различными
способами:
|
А3 |
Из воздуха и воды возможно
получение аммиачной селитры. Данный процесс
многостадийный:
|
Б1 |
Речь идет о черном фосфоре. Его сходство с графитом объясняется сходным строением их кристаллических решеток. |
Б2 |
Данный минерал – апатит, его состав можно выразить формулой Ca5(PO4)3(F, Cl) |
Б3 |
Речь идет о фосфорных кислотах:
H3PO4 - ортофосфорная, H4P2O7
- дифосфорная (пирофосфорная), HPO3 -
метафосфорная, неустойчивая, которая может
существовать в виде полимеров (HPO3)n.
Две последние образуются при постепенной
дегидратации (отщеплении молекул воды)
ортофосфорной кислоты при нагревании: |
В1 |
Извивающаяся змея – алхимический символ мышьяка (по причине ядовитости его соединений); хищный волк с раскрытой пастью – алхимический знак сурьмы, самого древнего элемента VА группы. Такой символ он получил из-за поразительной способности растворять многие металлы, в том числе и золото. |
В2 |
Тот “мышьяк”, который стоматолог помещает в дупло больного зуба для умерщвления нерва, на самом деле его оксид – As2O3 или мышьяковистая кислота H3AsO3 . |
В3 |
Данный элемент – сурьма. Основа средства для гримирования глаз и чернения бровей – минерал “сурьмяный блеск” - сульфид сурьмы Sb2S3 . |
4. Конкурс капитанов
Конкурс проводится с использованием ТСО – мультимедиапроектора, с помощью которого задание проецируется на экран для общего обзора. В качестве ответа капитаны заполняют таблицу на соответствие формул веществ и степеней окисления элементов VА группы (аналогично заданиям ЕГЭ из части В):
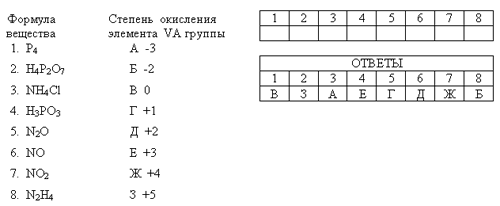
Каждый правильный ответ капитанов приносит команде 1 балл; первый справившийся с заданием получает добавочные 2 балла за скорость и право выбора дополнительных вопросов, каждый из которых оценивается в 1 балл. При неправильном ответе команда имеет право оказать помощь; если правильного ответа нет, на него отвечает команда соперников.
ДОПОЛНИТЕЛЬНЫЕ ВОПРОСЫ
- Какой аллотропной модификации соответствует формула P4? Какова геометрическая форма данной молекулы?
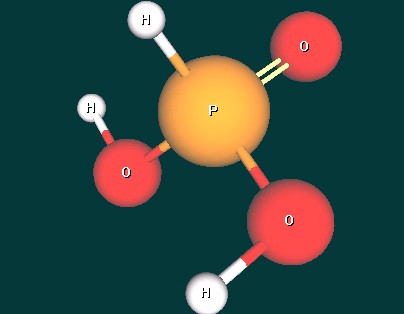
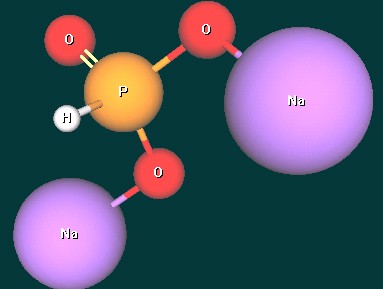
- Назовите кислоту H3PO3 и определите ее основность. Аргументируйте свой ответ.
- Какое производное аммиака используется в качестве реактивного топлива? Как оно называется?
- Назовите несолеобразующие оксиды азота.
- Какое вещество имеет тривиальное название “лисий хвост”? Почему? Определите его характер, докажите с помощью уравнения реакции.
- Какое из приведенных веществ имеет самую высокую температуру плавления? Почему?
ОТВЕТЫ
- Молекулярной формуле P4 соответствует белый фосфор. Геометрическая форма молекулы – тетраэдр; кристаллы по внешнему виду напоминают алмаз, также сильно преломляют солнечный свет, но на воздухе быстро превращаются в воскоподобную массу.
- H3PO3 - фосфористая кислота. Ее основность равна двум, так как только два атома Н связаны с атомами О и могут замещаться на атомы металлов при образовании солей, а третий – непосредственно с атомом Р. Это объясняется тем, что атом Р, в отличие от атома N, имеет больший радиус и его координационное число равно четырем. Поэтому формулу фосфористой кислоты можно записать и так: (HO)2POH. При наличии учебного электронного издания “Химия (8 – 11 класс). Виртуальная лаборатория” демонстрируется сборка модели молекулы фосфористой кислоты и образование ее натриевых солей с помощью Конструктора молекул.
- В качестве реактивного топлива используется гидразин N2H4, при сгорании 1 моль которого выделяется большое количество тепла, равное 625 кДж (для сравнения – при сгорании 1 моль водорода выделяется 241, 8 кДж).
- Несолеобразующие оксиды азота - N2O и NO.
- “Лисий хвост” - тривиальное название оксида азота NO2, которое он получил за характерный бурый цвет. Это кислотный оксид, которому соответствует две кислоты: азотистая и азотная: 2NO2 + H2O = HNO2 + HNO3 Данный процесс является реакцией диспропорционирования, или самоокисления-самовосстановления.
- Среди приведенных веществ самую высокую температуру плавления имеет NH4Cl – хлорид аммония, так как кристаллическая решетка этого вещества – ионная, остальные вещества имеют молекулярное строение.
5. “Бабушкина лаборатория”
В данном конкурсе участвуют по одному человеку от каждой команды, которые получают задания перед проведением конкурса капитанов и работают с ними за отдельными столами без помощи команд (“отправка сотрудников в командировку”).
Задание: В деревне у бабушки Веры потерялись этикетки от пакетов с минеральными удобрениями. Опытным путем определи, в каком пакете находятся следующие удобрения: натриевая селитра, сернокислый аммоний, аммофос, двойной суперфосфат и молотый сильвинит.
Так как предполагается отсутствие реактивов, определение минеральных удобрений в домашних условиях можно произвести с помощью раскаленного уголька, на который помещают щепотку исследуемого удобрения (Осторожно! Соблюдать правила техники безопасности: при нагревании в пламени спиртовки держать уголек тигельными щипцами, порцию удобрения наносить с помощью шпателя). Каждое правильно определенное удобрение приносит команде 1 балл, первому справившемуся с заданием – дополнительные 2 балла за скорость.
Удобрение |
Формула |
Внешний вид |
Действие на раскаленный уголек |
| Натриевая селитра | NaNO3 | Белый гигроскопичный порошок, при хранении слеживается. | Яркая вспышка вследствие выделения кислорода. |
| Сернокислый аммоний | (NH4)2SO4 | Мелкие светло-серые кристаллы. | Темнеет, образуется белый дым. Запах аммиака. |
| Аммофос | NH4H2PO4 | Мелкие светло-серые гранулы. | Плавится и кипит. Запах аммиака. |
| Двойной суперфосфат | Ca(H2PO4)2 | Серые гранулы. | Запах, напоминающий запах резины. |
| Сильвинит | KCl • NaCl | Смесь грязных белых и розовых кристаллов, напоминающих неочищенную поваренную соль | Потрескивание. |
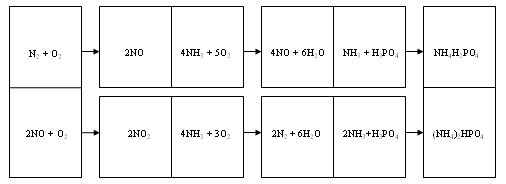
6. Химическое домино
Командам раздаются карточки (2 вертикальные и 4 горизонтальные), на половинках которых записаны начала и окончания разных химических реакций.
Задание: разложить карточки таким образом, чтобы получились две строчки записи правильных уравнений:
N2 + O2 = 2NO || 4NH3 + 5O2 = 4NO + 6H2O || NH3 + H3PO4 = NH4H2PO4
2NO + O2 = 2NO2 || 4NH3 + 3O2 = 2N2 + 6H2O || 2NH3 + H3PO4 = (NH4)2HPO4
Задание приносит командам 3 и 5 баллов соответственно времени выполнения.
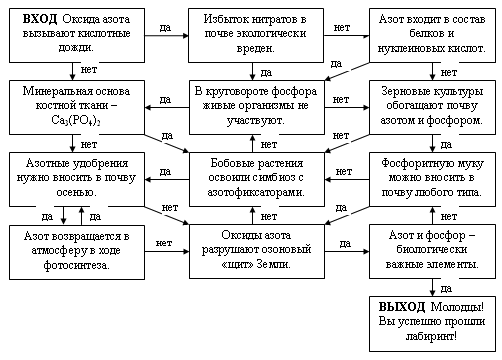
7. Экологический лабиринт
Команды получают листы с лабиринтом, на которых фломастером отмечают правильный путь. Если команда согласна с утверждением, нужно двигаться по стрелке “да”, если считает утверждение ложным – по стрелке “нет”. Каждый правильный шаг приносит команде 1 балл; команда, первая справившаяся с заданием, получает дополнительные 2 балла.
8. Подведение итогов
По результатам набранных баллов объявляется команда-победитель. В зависимости от степени активности и правильности ответов участники получают положительные оценки. Самому активному участнику предоставляется право зажечь прощальный “костер” (опыт “Вулкан на столе” - разложение дихромата аммония) под песню “Ночной костер” в исполнении Л. Вайкуле.
Список литературы
- Популярная библиотека химических элементов. Книга 1-ая. – 3-е изд., исправл. и доп. - М.: “Наука”, 1983
- Фадеев Г. Н. Пятая вертикаль: Элементы V группы периодической системы Д. И. Менделеева. Книга для учащихся. – 2-е изд., перераб. - М.: “Просвещение”, 1985
- Смирнов Н. А. Домашний огород. – 2-е изд., перераб. и доп. – М.: Россельхозиздат, 1982