Цели:
- проверить уровень усвоения материала;
- развивать внимание, интерес к предмету, мышление, быстроту реакции;
- поддерживать дисциплину при проведении игр.
Оборудование: карточки с баллами, звёздочки, ручки, листочки, таблички с цифрами 1, 2, 3, 4, призы.
"Человек чего-то добивается, потому что верит в свои силы."
Людвиг Фейербах
ХОД УРОКА
I. Инструктаж
Ведущий называет тему конкурса, формулирует вопрос и приводит 4 варианта ответов (они предварительно записаны на доске или плакате). По сигналу учителя учащиеся поднимают табличку с цифрой, которая, по их мнению, соответствует правильному варианту ответа. За правильный ответ каждый получает по 1 баллу. После каждого конкурса один из учащихся даёт пояснение. Если на вопрос правильно ответили не более 3-х человек, наряду с баллом каждый из них получает и звёздочку, которая даёт право на одну подсказку в финале (подсказать может любой учащийся, которого выбирает финалист); тот, кто неверно дал отчёт, выбывает из игры, получая утешительный приз. Два участника игры, набравшие большее число баллов в предварительных конкурсах, выходят в финал, где и разыгрывают первое место. Финалистам ставятся “5”. Победителю вручается памятный приз.
II. Проведение игры (вопросы конкурсных заданий)
Конкурс 1.
Задание: Знаете ли вы названия веществ?
Учитель показывает формулу Ca(H2PO4)2 и задает вопрос: “Как называется вещество”?
Варианты ответов:
1. Суперфосфат простой;
2. Сульфат калия;
3. Суперфосфат двойной;
4. Нитрат аммония.
Ответ: суперфосфат двойной.
Конкурс 2.
Задание: расшифруйте название удобрения, укажите формулу.
НННАООООМРРРРРМККККОИИИИИФЕЕЕЕЕОЧЧЧЧС
Ответ: аммофос.
Конкурс 3.
Задание: в двух пробирках находятся различные нитраты белого цвета. При нагревании одной соли выделяется бесцветный газ, в котором тлеющая лучинка вспыхивает. При нагревании второй соли выделяется газ бурого цвета. Определите эти соли.
Варианты ответов:
1. NaNO3 и Mg(NO3)2;
2. NH4 NO3 и KNO3;
3. KNO3 и NaNO3 ;
4. KCI и Mg(NO3)2.
Ответ: NaNO3 и Mg(NO3)2.
Конкурс 4.
Задание: из твёрдых азотных удобрений это удобрение наиболее концентрированное. При умеренной влажности воздуха оно не поглощает воду, поэтому при хранении мало слёживается. В почве оно превращается в соли аммония. Его употребляют и как кормовое средство.
Ответ: мочевина – CO(NH2)2
Конкурс 5.
Задание: вам предлагается три группы удобрений, по 4 в каждой группе. Они сгруппированы по наличию одного питательного элемента, но одно удобрение в каждой группе не имеет этого питательного элемента и поэтому является лишним. Определите, какое лишнее. Обоснуйте свой ответ.
| I. (азотные) карбамид |
II. (фосфорные) натриевая
селитра |
III. (калийные) хлорид
калия |
Ответ: лишнии
- I группа – костяная мука;
- II группа – натриевая селитра;
- III группа – чилийская селитра.
Конкурс 6.
Задание: заполните пустые клетки, восполнив недостающие звенья. Укажите формулу веществ, их название и к какой группе удобрений они относятся.
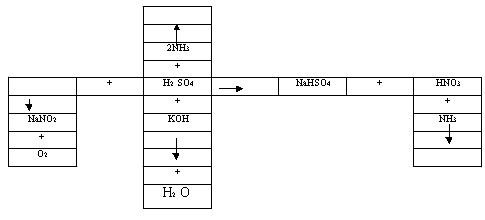
Ответ: азотные – NaNO3 – чилийская селитра, (NH4)2SO4 – сульфат аммония, NH4NO3 – аммиачная селитра, калийные – K2SO4 – сульфат калия.
Финал. Химия + Математика
Задача. Массовая доля азота в удобрении составляет 14%. Весь азот входит в удобрение в составе мочевины CO(NH2)2. Вычислите массовую долю мочевины в этом удобрении.
Варианты ответов:
1. 20%
2. 60%
3. 30%
4. 48%
Решение:
Выбираем для расчётов образец удобрения массой
100 г, т.е. m (удобрения) = 100 г.
Определяем массу азота в этом образце.
m (N) = m (удобрения) . w (N);
m (N) = 100 . 0,14 г = 14 г.
Количество вещества азота составляет
n (N) = m (N) / M (N);
n (N) = 14/14 моль = 1 моль.
Из формулы мочевины CO(NH2)2 следует:
n (CO(NH2)2) = n (N)/2;
n (CO(NH2)2) = 1/2 моль = 0,5 моль.
Находим массу мочевины:
n (CO(NH2)2) = n (CO(NH2)2) . M (CO(NH2)2);
n (CO(NH2)2) = 0,5 . 60 г = 30 г.
Определяем массовую долю мочевины в образце:
w (CO(NH2)2) = m (CO(NH2)2)/ m (удобрения);
w (CO(NH2)2) =30/100 = 0,3, или 30%.
Ответ: 30%.