Выполнила:
Иванова Елена,
ученица 10 класса
Руководитель:
Иванова О.И.,
учитель химии и биологии
Напольнокотякской СОШ
ВВЕДЕНИЕ
Актуальность исследования
В настоящее время одной из самых актуальных проблем является проблема экологии. Чистая вода становится «товаром номер один» в мире и по некоторым прогнозам в ближайшее десятилетие будет наиболее продаваемым и дорогим продуктом. Вода оказывает огромное влияние на здоровье человека. Для того, чтобы хорошо себя чувствовать, человек должен употреблять только чистую качественную питьевую воду. Учёными давно установлена прямая связь между качеством питьевой воды и продолжительностью жизни. Это неудивительно, учитывая, что по данным Всемирной организации здравоохранения около 90% болезней человека вызывается употреблением для питьевых нужд некачественной воды, а также использование неподготовленной воды в бытовых целях (душ, ванна, бассейн, мытье посуды, стирка белья и т.д.). В настоящее время вопросы качества питьевой воды не утратили своей актуальности.
Цель: изучение качества питьевой воды в Напольнокотякской СОШ.
Задачи:
- Изучить литературные источники о свойствах воды и экологических проблемах;
- Практически ознакомиться с методикой определения жесткости воды и рН;
- Провести анализ питьевой воды из буровой скважины Напольнокотякской СОШ в лабораторных условиях;
- Дать рекомендации местному населению;
Объект исследования - питьевая вода из скважины Напольнокотякской СОШ.
Предмет исследования – качество питьевой воды.
Методы исследования:
- Лабораторные исследования в школьных условиях.
- Изучение результатов проб водопроводной воды.
- Изучение теоретического материала.
Практическая значимость: Данная исследовательская работа позволит получить информацию о состоянии качества воды школы, поможет привлечь внимание администрации школы и общественности к данной проблеме.
Обзор литературы
Нами были рассмотрены различные книги и статьи по теме: значение питьевой воды, проблемы загрязнения воды, методике проведения анализа воды.
Боровский Е.Э. «Вода в природе. Дефицит чистой пресной воды» говорит о роли воды в биосферных процессах. Она обладает очень высокой теплоёмкостью, теплотой плавления и испарения. Самым большим поверхностным натяжением, диэлектрической проницаемостью и растворяющей способностью. Так же он отмечает основные причины дефицита пресной воды и пути их преодоления. Среди главных причин дефицита – антропогенное химическое загрязнение воды. [1]
Химия: Проектная деятельность учащихся. Автор Ширшина Н.В. Приведены примеры исследовательских работ. Описана методика определения рН. [2]
Курлыкова С.В. «Опыты по очистке воды». Затронута проблема качества питьевой воды. Приведены способы очистки питьевой воды и оценка качества очистки различными способами. [11]
В статье Р.Давлетшина «Вода – от реки до реки» описаны источники загрязнения пресной воды: промышленными и бытовыми отходами. Так же рассказывается о системах очистки воды. О проблемах, связанных с очисткой воды. О расходе потребления воды. [9]
Габриелян О.С. «Вода в нашей жизни» Элективный курс. В виде лекций описывается роль воды на Земле, строение молекул воды, физические и химические свойства воды. [7]
Также много рассказано о значении воды в статьях: «Вода - растворитель» С.М.Некрасова, «Вода – основа жизни» Ф.И.Голованова, «Вода – очистка воды» С.С. Залетило. [12, 8, 10]
В своей работе я использовала материалы интернет-сайтов, где описаны различные методики анализа воды, а также методика написания исследовательских работ.
ОСНОВНАЯ ЧАСТЬ
Раздел 1. Качество питьевой воды
Показателем качества питьевой воды является её минерализация. Общая минерализация — это количественный показатель содержания растворенных в воде веществ. Его еще называют солесодержанием, так как вещества, растворенные в воде, находятся в виде солей. Наиболее распространенные неорганические соли (гидрокарбонаты, хлориды и сульфаты кальция, магния, калия и натрия) и небольшое количество органических веществ, растворимых в воде [14]. Решая вопрос о том, в каком количестве те или другие соли могут содержаться в воде без вреда для здоровья человека, учёные проводят эксперименты на лабораторных животных, изучают влияние воды различного солевого состава на состояние здоровья людей, длительное время её потребляющих. В результате исследований устанавливаются безвредные уровни содержания в питьевой воде различных солей, которые выражаются в граммах вещества или иона на литр воды и называются предельно допустимыми концентрациями (ПДК) [13].
Согласно ГОСТу СанПиН 2.1.4.1074-01 вода признанная питьевой «должна быть безопасна в эпидемическом и радиационном отношении, безвредна по химическому составу, и иметь благоприятные органолептические свойства». В соответствии с действующими стандартами и нормами под термином питьевая вода высокого качества подразумевается: по органолептическим показателям - это прозрачная вода, без запаха и с приятным вкусом; жесткость не выше 7–10 градусов жёсткости; суммарное количество полезных минералов не более 1000 мг/л; вредные химические примеси либо составляют десятые-сотые доли предельно допустимых концентраций (ПДК), либо вообще отсутствуют (то есть их концентрации очень малы); болезнетворные бактерии и вирусы отсутствуют [13].
Раздел 2. Методика исследований [2, 13]
2.1 Определение органолептических показателей качества воды
Материалы и оборудование: Пробирки, листы писчей бумаги, лампа, тёмная бумага, штатив для пробирок.
Ход работы
- Заполнить пробирку исследуемой водой на высоту 10-12 см.
- Определить мутность воды, рассматривая пробирку на темном фоне при достаточном боковом освещении и цветность воды, рассматривая пробирку на белом фоне листа писчей бумаги. Выбрать подходящую степень мутности по типам:
- Также определить цветность, характеризуя цвет воды в пробирке высотой 10-12 см.
- Для определения запаха: Налить в пробирку исследуемую воду и закрыть пробкой. Через 10 минут открыть пробки у пробирок и определить запах воды.
2.2. Определение рH
Материалы и оборудование: исследуемая вода, пробирки, универсальная индикаторная бумага, контрольная шкала образцов окраски растворов для определения рН.
- В пробирку налить 10 мл. испытуемой воды.
- Опустить в пробирку универсальную индикаторную бумагу.
- Сравнить её окраску со шкалой.
2.3 Обнаружение хлорид-ионов в воде
Материалы и оборудование: водные растворы; концентрированный раствор нитрата серебра; пробирки.
Ход работы
- Налить в пробирку 2 мл испытуемого раствора
- Долить к нему 1 мл концентрированного раствора AgNO3.
- Имеющиеся хлориды в растворах дают устойчивый белый осадок хлорида серебра (AgCI).
2.4 Обнаружение сульфат-ионов в воде
Материалы и оборудование: водный раствор, 10% раствор соляной кислоты (HCl), гидроксид бария (Вa(OH)2), пробирки.
Ход работы
- Добавить в пробирку с исследуемой водой 10 капель раствора соляной кислоты и 2 капли раствора гидроксида бария.
- Наблюдать в течение 3 мин. за помутнением раствора.
- Имеющиеся сульфаты в растворах проявляются в соединении сульфат бария (BaSO4), который даёт белый осадок.
Жесткость воды. Жесткая вода отличается наличием в ней солей кальция и магния. Эта вода нежелательна как для употребления внутрь, так и для наружного применения. Она плохо усваивается организмом, откладывается в различных органах и тканях (суставы, сосуды) человека, затрудняя их нормальное функционирование.
Различают общую, временную и постоянную жесткость воды. Общая жесткость обусловлена главным образом присутствием растворимых соединений кальция и магния в воде.
Временная жесткость иначе называется устранимой или карбонатной. Она обусловлена наличием гидрокарбонатов кальция и магния.
2.5. Определение временной жесткости воды
а) качественный анализ
Подействовали на небольшую часть сухого остатка раствора соляной кислоты. Наблюдали «вскипание» с выделением пузырьков газа.
Вывод: вода обладает гидрокарбонатной жесткостью.
б) количественный анализ
Способ основан на реакции между соляной кислотой и гидрокарбонатами:
Ca(HCO3)2+2HCl→CaCl2+2H2O+2CO2
При титровании кислотой, добавленной в воду, индикатор метилоранж изменяет свою окраску, когда в растворе появляется небольшой избыток кислоты.
Отмерили с помощью мерного цилиндра 100 мл воды и перенесли в коническую колбу для титрования, прибавили по 1-2 капли метилоранжа. Для удобства определения точки эквивалентности, в другой колбе приготовили раствор «свидетеля» - к 100 мл дистиллированной воды прибавили по 1-2 капли метилоранжа и соляной кислоты. В первую колбу приливали из бюретки по каплям 0,1н раствор соляной кислоты до тех пор, пока от одной капли кислоты окраска из желтой перейдет в оранжево-красную (цвет сравнивают с окраской свидетеля»).
Титрование повторяют 2-3 раза. Для расчетов принимают средний результат.
№ |
V(H2O), мл |
V(HCl), мл |
V(HCl),средн, мл |
|
100 |
6,12 |
6,07 |
|
100 |
6,0 |
|
|
100 |
6,10 |
Значение карбонатной жесткости воды рассчитывают по следующей формуле:
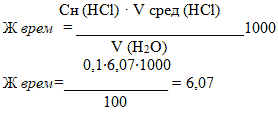
2.6. Обнаружение ионов аммония в воде
Материалы и оборудование: водные растворы; концентрированный раствор едкого натра (NaOH), цинковая пыль, спиртовка, зажим, фенолфталеиновая бумага, лакмусовая бумага, дистиллированная вода, пробирки.
Ход работы
- Налить в пробирку 1 мл испытуемого раствора
- Добавить к нему 1 мл концентрированного раствора NaOH и добавили немного цинковой пыли.
- Для ускорения реакции смесь подогреть.
- Имеющиеся ионы аммония в растворах восстанавливаются до аммиака. Аммиак определяется по покраснению бесцветной фенолфталеиновой бумаги или по покраснению лакмусовой бумаги, смоченных в дистиллированной воде и внесённых в пары.
3. ЗАКЛЮЧЕНИЕ
3.1. Органолептические показатели воды
Мутность |
Цветность |
Запах при 20o С |
Мутность отсутствует |
Бесцветная |
Запах не ощущается. |
3.2 Определение рH
Водородный показатель исследуемой воды рН = 8, значит среда раствора слабощелочная (универсальная индикаторная бумага зеленовато-голубая).
Обнаружение хлорид-ионов в воде.
В результате реакции в пробирке появилась слабая опалесценция. Это говорит о наличии хлоридов в исследуемом растворе в количестве 1-10 мг/дм3
Обнаружение ионов аммония в воде.
При внесении фенолфталеиновой бумаги в пары, она цвет не изменила. Это значит, что ионы аммония в исследуемой воде отсутствуют.
Обнаружение сульфат-ионов в воде.
В результате проведения опыта осадок в пробирке образовался легкий белый осадок. Содержание по таблице составляет ~ более 10 мг/ дм3.
Определение временной жесткости воды
Расчеты показали, что временная жесткость воды составляет 6,07 ммоль/л, что является показателем средней жесткости.
Для подтверждения или опровержения полученных результатов мы дали нашу воду на лабораторный анализ в испытательный лабораторный центр (Шихазаны). Их анализ подтвердил наши результаты. Значит, и в школьных условиях с минимальным оборудованием можно проверить качество воды.
Выводы
В результате исследования литературных источников и проведённых опытов с питьевой водой обнаружилось, что наша школьная вода неплохого качества. Параметры полученных результатов не выходят за пределы допустимых значений. Я рекомендую школьную воду для питья всем учащимся нашей школы.
Работа по изучению качества питьевой воды оказалась интересной и полезной не только для меня и моей семьи, но и для моих друзей. В будущем можно исследовать влияние воды в нашей местности на здоровье сельчан.
Список используемой литературы
- Вода в природе. Дефицит пресной воды./ Е.Э.Боровский – М.: Чистые пруды, 2009.
- Ширшина Н. В. Химия: проектная деятельность учащихся. Изд. «Учитель», 2008.
- Назарова Т.С. Химический эксперимент в школе. – М.: Просвещение, 1987.
- Химия: Проектная деятельность учащихся/ Авт-сост. Н.В.Ширшина. - Волгоград: Учитель, 2008.
- Габриелян О.С. и др. «Вода в нашей жизни», учебно-методическая газета для учителей химии « Химия «Первое сентября»», №5,6, 2009.
- Голованова Ф.И. «Вода – основа жизни», учебно-методическая газета для учителей «Химия «Первое сентября»», №7, 2008.
- Давлетшин Р. «Вода – от реки до реки», экологическая газета Подрост, № 5-6,2002.
- Залетило С.С. «Вода – очистка воды», учебно-методическая газета для учителей химии «Химия «Первое сентября»», №17, 2008.
- Курлыкова С.В. «Опыты по очистке воды», учебно-методическая газета для учителей химии «Химия «Первое сентября»», №4, 2009.
- Некрасова С.М. «Вода - растворитель», учебно-методическая газета для учителей химии «Химия «Первое сентября»», №10, 2008.
- http://portfolio.1sept.ru/work.php?id=582810
- Здоровье всей семьи. Полная энц. Для всех и каждого/ Сост. Г.А.Лапис. - СПб: ИД «ВЕСЬ»,2003.-720 с.
- Химия. Предметные недели в школе: планы и конспекты мероприятий/авт.-сост. Л.Г.Волынова и др. Волгоград: Учитель, 2007.-142 с.
- Дерпгольц В.Ф. Мир воды. - Л.: Недра, 1979.-254 с.









