Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать,
тобой наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни:
ты — сама жизнь. Ты наполняешь нас радостью, которую не объяснить нашими чувствами.
А. де Сент-Экзюпери (слайд 2)
Задачи урока:
- Узнать всё о воде, а именно: её физические и химические свойства; зачем она нужна, и как её сберечь.
- Придумать свои экологические способы, показывающие, как можно сберечь воду, чтобы планета Земля всегда была райским уголком в нашей Вселенной.
- На основе полученных знаний сформировать навыки экологической культуры, а также чувство прекрасного, бережного отношения к воде (слайд 3).
Средства обучения. Телевизор, видеофильм “Вода” (оксфордская видеоколлекция для детей), физическая карта мира, дополнительный материал по теме “Вода”, оксид фосфора (V), оксид кальция, калий, кальций, медь, лакмусовая бумажка, вода в колбе, химические стаканы, спиртовка, держатель, спички, пробирки (слайд 4).
Тип урока. Изучение нового материала
Вид урока. Урок-дискуссия
Музыкальное сопровождение урока: Николас Ганн “Музыка Великого каньона”
Основные вопросы:
1. Актуализация знаний.
2. Вода в природе.
3. Физические свойства воды.
4. Химические способности воды.
Ход урока
1. Игра “Да — нет”
Ученики задают вопросы учителю. Школьник, задавший неправильный вопрос, выбывает из игры. Необходимо оценить учеников, задающих правильные и интересные вопросы.
- Это сложное вещество? (да)
- Оно относится к классу кислот? (нет)
- Вещество состоит из двух элементов? (да)
- Эти элементы называются азот и водород? (нет)
- Это вещество оксид? (да)
- В молекуле этого вещества два атома кислорода? (нет)
- В молекуле этого вещества два атома водорода и один атом кислорода? (да)
- Формула этого вещества Н2О? (да) (слайд 5).
Учитель. Это вещество — вода! Если собрать все научные исследования о воде и процессах, идущих с её участием, получится огромная библиотека. Учитель открывает тему, записанную на доске: “Эта необыкновенная, живая вода” (учащиеся записывают тему урока в тетрадь).
Начинается дискуссия: в ней принимают участие ребята — консультанты и остальные учащиеся. Ребята сопровождают свой рассказ различными рисунками о воде.
Учитель. Почему вода – живая?
Первый консультант. “Вода... — это та живая кровь, которая создаёт жизнь там, где её не было”, — сказал академик Александр Петрович Карпинский (слайд 6).
Она растворяет и переносит по кровеносным сосудам и капиллярам вещества для обмена. Кроме того, она катализатор большинства процессов. Можно утверждать, что ни один процесс обмена веществ не происходит без участия воды. Она поистине “носитель жизни”.
Вода — “сок жизни”, — сказал Леонардо да Винчи.
Учитель. Почему вода необыкновенная?
Второй консультант. Вода уже в глубокой древности возбуждала ум и воображение человека. В глазах наших далёких предков ничто не могло сравниться с силой воды. Она нисходила с небес, часто в сопровождении грома и молнии. Вытекая из гор, она струилась по земле и уходила в моря. Люди видели, как плодородные пашни и луга без воды превращаются в бесплодные пустыни. В самой воде зарождаются и живут рыбы и растения, без воды не могут существовать ни человек, ни животные.
За шесть столетий до нашей эры философ Фалес из греческого города Милет уже знал, что вода является единственным веществом на Земле одновременно в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Его выражение “Вода — первооснова всего” было принято в древнем мире. “Когда вода спускается с небес, то она является причиной всего растущего на Земле.... Это даёт основание вывести заключение, что все силы на Земле исходят из воды”, — писал древнеримский писатель-эрудит Плиний Старший (23–79 гг. н. э.) в своей многотомной “Естественной истории” (слайд 7).
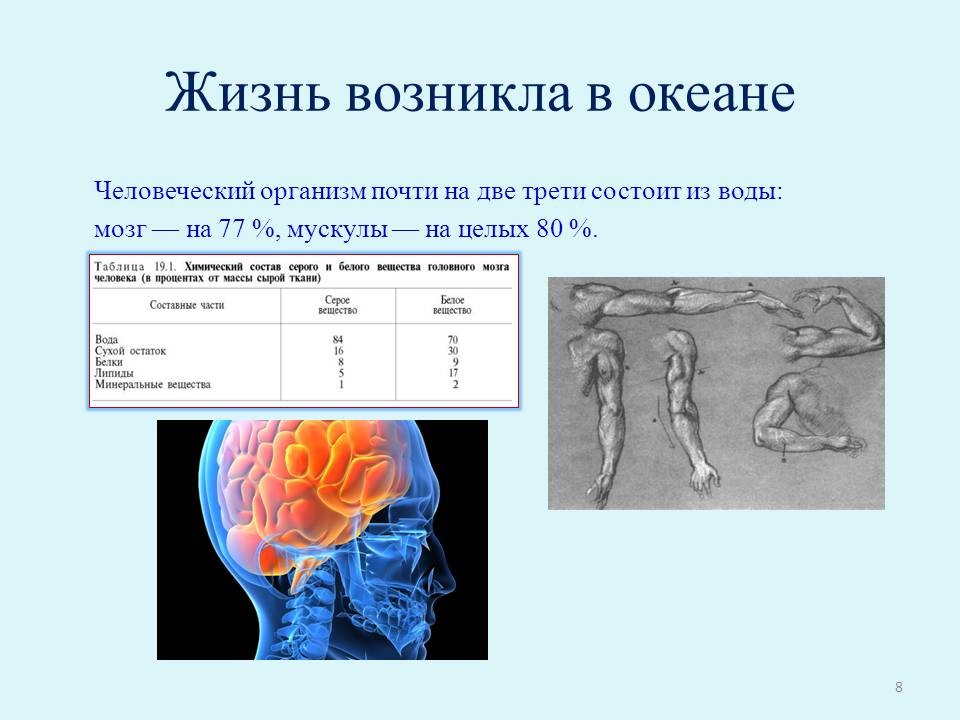
Жизнь возникла в океане, и мы буквально созданы из воды. Человеческий организм почти на две трети состоит из этого вещества: мозг — на 77 %, мускулы — на целых 80 % (слайд 8).
Третий консультант. Когда–то академик Александр Евгеньевич Ферсман назвал пресную воду “самым важным минералом на Земле, без которого нет жизни”. С каждым годом это становится всё более непреложной истиной. Вода является единственным веществом, которое практически очень трудно заменить (слайд 9).
Четвёртый консультант. Взгляните на карту мира. ? Земного шара покрыто водой. Больше всего на ней голубой краски. А голубым цветом на карте изображают воду. Она находится в океанах и морях, реках и озёрах, под землёй и в почве. На высоких горах, в Арктике и Антарктиде вода представлена в виде снега и льда. Много её в атмосфере: это облака, туман, пар, дождь, снег (слайд 10).
Пятый консультант. Вы слышали, как шумит море, течёт река, журчит ручеёк? Какой будет наша Земля, если вода исчезнет?!
Шестой консультант. Мы не допустим экологической катастрофы. Вода — это богатство, которое нужно беречь.
Второй консультант. Предлагаю посмотреть видеофильм о воде (все смотрят фильм).
Учитель. “Вода всегда такая разная: жидкая, твёрдая, газообразная.
Вода речная и вода из океана, вода, текущая из крана — все они едины.
Их всех объединяют свойства.
Об этих свойствах сегодня мы будем говорить.
Тем самым, пополняя наши знания о веществе — вода.
А, зная свойства, вы догадаетесь, зачем она нужна.
И будем помнить мы всегда: пока журчит вода,
Будь то ручеёк или огромный океан.
Возможна жизнь на Земле”.
Это цель нашего урока (слайд 11).
Учитель на доске чертит схему:
(слайд 12)
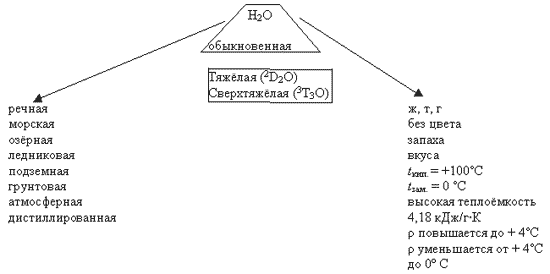
Учитель. О каких водах вы сейчас услышали?
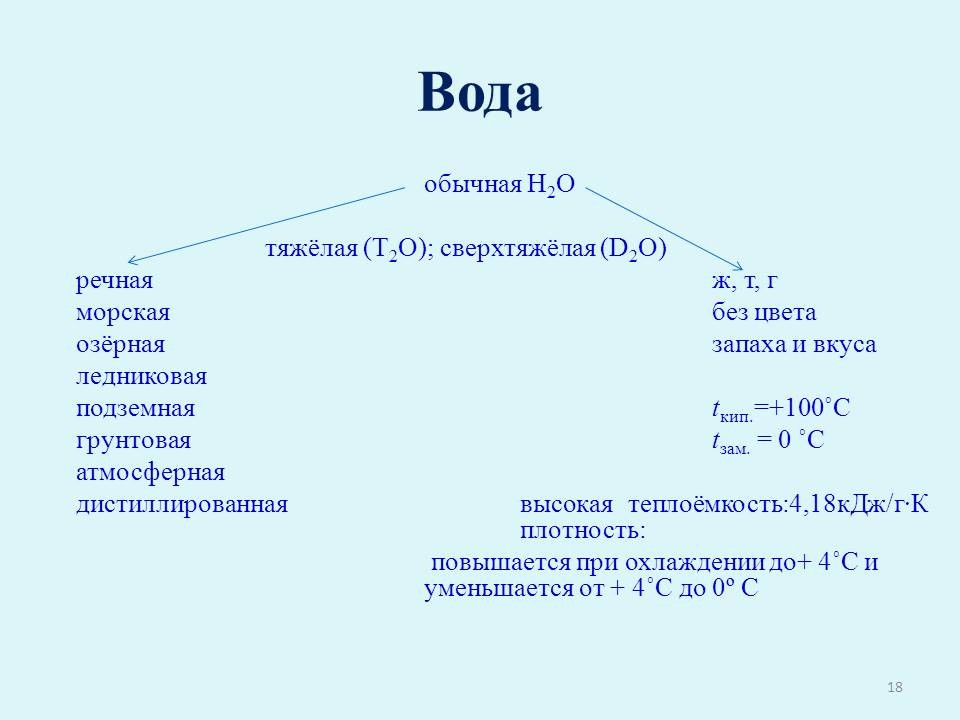
Седьмой консультант. О речной, морской, озёрной, ледниковой, подземной (грунтовой), атмосферной. Ещё есть вода дистиллированная, она совершенно не вкусная, так как в ней нет солей, нужных живым организмам. Такую воду получают в лаборатории.
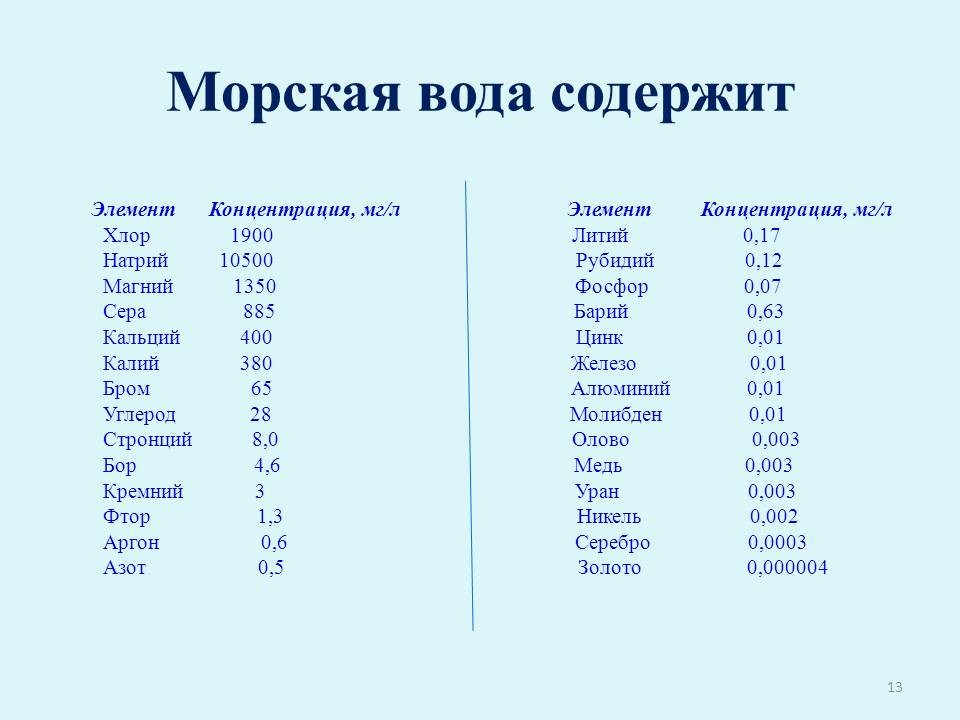
А вот морская вода интересна тем, что в ней содержатся в разных количествах практически все элементы периодической системы Д.И. Менделеева. В ней больше всего содержится натрия, хлора, магния. Поэтому она горько-солёная. Количество других элементов в морской воде можно посмотреть в таблице (слайд 13).
Учитель. Поговорим о физических свойствах воды.
Пятый консультант. Вода — носитель жизни (демонстрирует колбу с водой).
При обычных условиях, это жидкость, без цвета, вкуса и запаха; может находиться в трёх состояниях: в виде льда, пара и жидкости. Кипит при 100oС, замерзает при 0oС. При замерзании она расширяется (увеличивается в объеме) на 11 %, бутылка с минеральной водой может при этом взорваться (слайд 14).
Многие физические свойства воды обнаруживают существенные отклонения. Учёные насчитали 40 аномалий, характерных для воды.
Плотность воды повышается до + 4?С, как и у большинства других жидкостей. Однако, достигнув максимального значения — 1000 г/см при + 3, 98?С, при дальнейшем охлаждении уменьшается. Тогда как у других веществ, наоборот плотность увеличивается. Вязкость воды с ростом давления уменьшается, а не повышается, как следовало бы ожидать. Поверхностное натяжение воды уступает только ртути. Электропроводность воды весьма мала. Вода имеет наибольшую теплоёмкость — 4,18 кДж/г*К. Она очень сильно поглощает невидимые инфракрасные (тепловые) лучи. Полученное тепло вода отдаёт в окружающую среду – это имеет важнейшее значение для температурного режима нашей планеты. Воду можно назвать регулятором климата на Земле и относиться к воде нужно очень бережно (слайд 15).
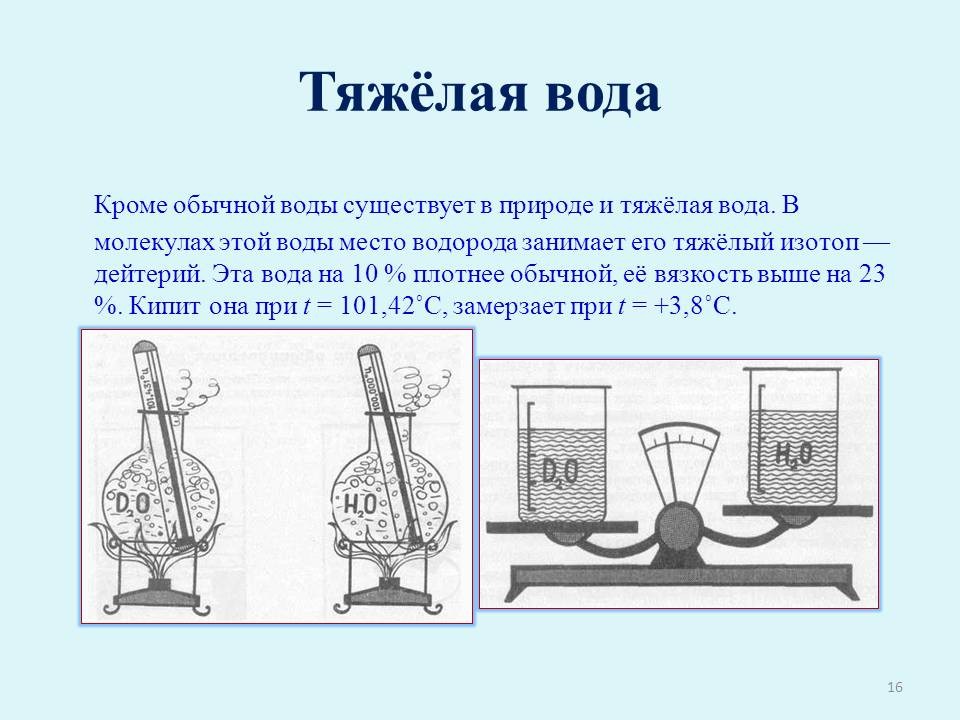
В составе обычной воды (Н2О) имеется небольшое количество тяжёлой воды (D2O) В молекулах этой воды место водорода занимает его тяжёлый изотоп — дейтерий. Эта вода на 10 % плотнее обычной, её вязкость выше на 23 %. Кипит она при t = 101,42oС, замерзает при t = +3,8oС
(слайд 16). Также есть и сверхтяжёлая вода (Т2О).
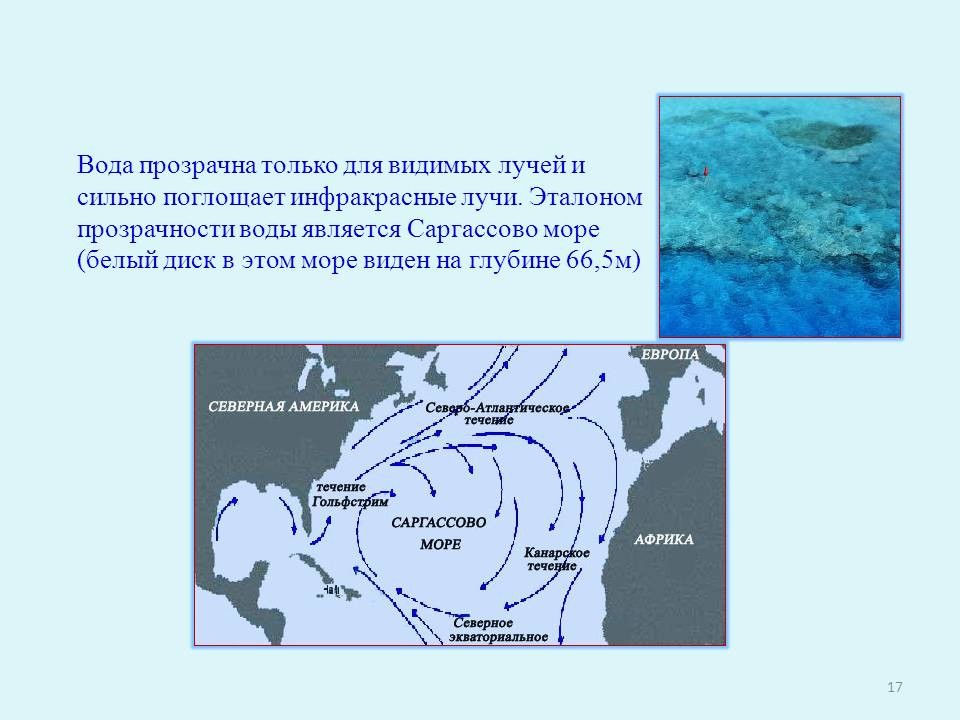
Вода прозрачна только для видимых лучей и сильно поглощает инфракрасные лучи. Эталоном прозрачности воды является Саргассово море (белый диск в этом море виден на глубине 66,5м) (слайд 17).
Во время рассказа учащиеся постепенно заполняют схему, представленную на слайде 11.
Обобщают знания о воде, посмотрев (слайд 18).
Третий консультант. Все живые организмы состоят из воды и органических веществ. Без воды человек может прожить не более 2–3 дней. В организме растений и животных содержится более 50 % воды, в почве — не менее 20 % , в организме человека — 65 %.
По расчётам специалистов в составе мантии Земли воды содержится в 10–12 раз больше, чем в Мировом океане. Мировой океан покрывает 71 % поверхности планеты и содержит 97,6 % мировых запасов воды. Реки и озёра содержат 0,3% мировых запасов воды.
Большими хранилищами воды являются ледники, в них сосредоточено 2,1 % мировых запасов воды (слайд 19).
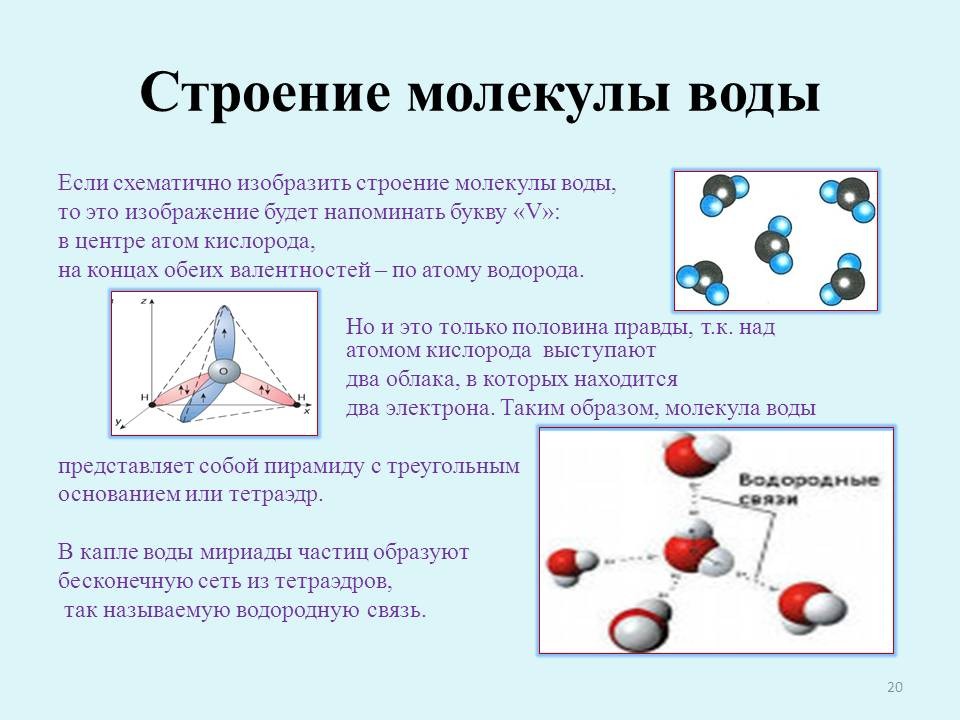
Шестой консультант. Если схематично изобразить строение молекулы воды, то это изображение будет напоминать букву “V”: в центре атом кислорода, на концах обеих валентностей – по атому водорода. Но и это только половина правды, т.к. над атомом кислорода выступают два облака, в которых находится два электрона. Таким образом, молекула воды представляет собой пирамиду с треугольным основанием или тетраэдр.
В капле воды мириады частиц образуют бесконечную сеть из тетраэдров, так называемую водородную связь (слайд 20).
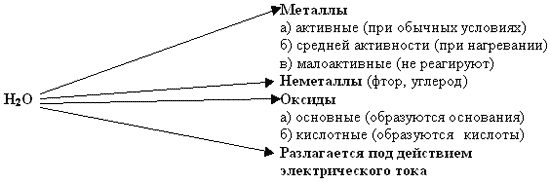
Учитель. Благодаря такому строению вода обладает удивительными “химическими способностями”. Какими – же?
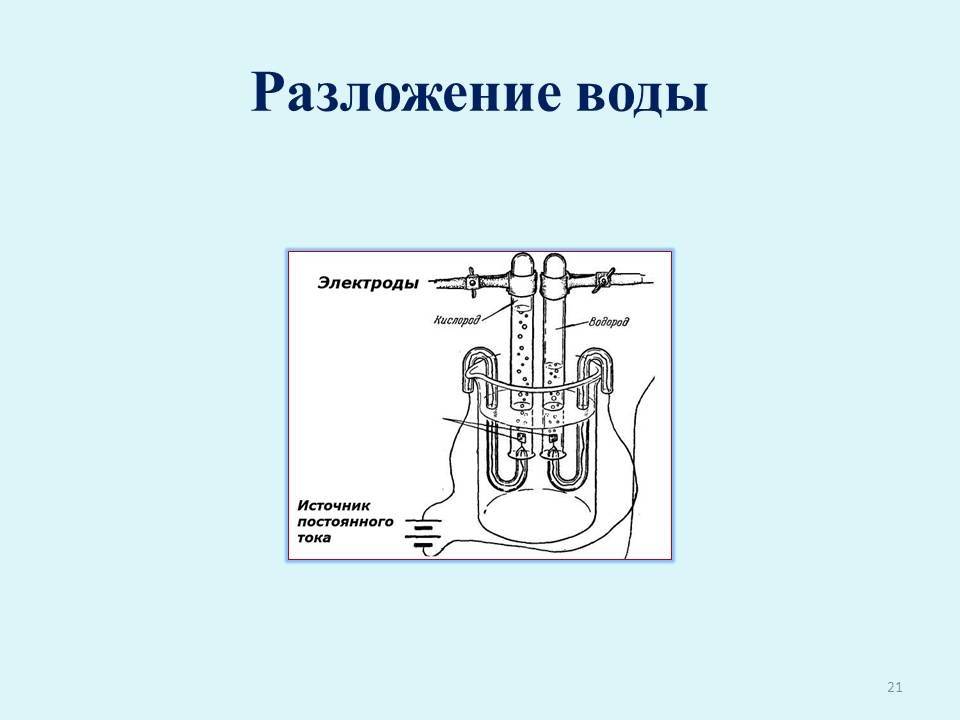
Девятый консультант. Молекула воды очень прочна. Разложение заметно лишь при 2000oС при действии электрического тока (слайд 21). При этом образуется водород и кислород. Записывает уравнение реакции на доске, все остальные в тетрадях.
2Н2О —> 2Н2
+ О2
В романе Жюль Верна “Таинственный остров” написано, что “вода — это уголь грядущих веков”.
Ученик зачитывает отрывок из романа: “Вода заменит уголь, но вода, разложенная на составные части. Без сомнения это будет делаться при помощи электричества, которое в руках человека станет могучей силой. Водород и кислород, из которых она состоит, будут применяться и раздельно. Они окажутся неисчерпаемым и таким мощным источником тепла и света, что углю до них далеко!” (слайд 22).
Второй консультант. Кислород, который выделится при разложении воды, можно “выпустить” в атмосферу, он освежит воздух.
Первый консультант. Я знаю, что вода используется как реагент при различных химических процессах. С её помощью можно получить много веществ. Например, можно получить водород, щёлочи, оксиды (слайд 23).
Взаимодействие воды с калием, кальцием, медью смотрим на видео (слайды 24,25).
Консультант записывает уравнения реакций на доске, все остальные в тетрадях.
2К +2H2O = 2КOH + H2
(при обычных условиях)
Са+ H2O = Са(OН)2 + H2
Cu + H2O (не реагирует)
Учитель (поясняет). Вода реагирует с металлами по-разному. Это зависит от активности металла:
- наиболее активные – при обычных условиях;
- средней активности – при нагревании;
- малоактивные – не реагируют.
Активность металла можно установить, посмотрев на ряд напряжения металлов Николая Николаевича Бекетова. В начале ряда находятся активные металлы, далее – средней активности, а после водорода – малоактивные металлы (слайд 26).
Шестой консультант. В справочнике школьника написано, что холодная вода может реагировать с фтором, при этом образуется фтороводород и кислород:
2F2
+ 2H2O = 4HF
+ O2
(слайд 27).
Вода реагирует с горящим углем:
С + Н2О —> СО
+ Н2
(при нагревании)
(записывает уравнения реакции на доске, все остальные в тетрадях).
Третий консультант. В выбросах промышленных предприятий содержится оксид серы (VI) SO3. С капельками воды из воздуха он образует серную кислоту, и тогда можно наблюдать явление природы — кислотные дожди:
SO3 + H2O = H2SO4.
Оксид фосфора (V) очень хорошо поглощает влагу, используется как осушитель газов (Демонстрация опыта).
(записывает уравнение реакции на доске, все остальные в тетрадях). Так вода реагирует с кислотными оксидами.
А ещё есть основные оксиды (оксиды металлов), вода также вступает с ними в химическую реакцию, но образуется основание:
Смотрим опыт: взаимодействия оксида кальция с водой (Демонстрация опыта).
СаO + H2O = Са(OH)2
(записывает уравнение реакции на доске, все остальные в тетрадях).
Учитель. Я предлагаю вам заполнить схему “Химические способности воды” (слайд 28).
Десятый консультант. Вода наш добрый друг и помощник. Она удобная дорога: по морям и океанам плавают корабли, именно поэтому многие города возникли на берегах рек. Вода побеждает засуху, оживляет пустыни, повышает урожай полей и садов. Для посевов очень полезен летний грозовой дождь, ибо грозовая вода в отличие от обычной содержит большое количество ионизированных частиц, благотворно влияющих на жизнедеятельность растений.
По данным статьи (журнал “Химия в школе”) курс лечения снеговой водой полных людей приводит к потере веса от 10 до 15 кг за три месяца (слайд 29).
Третий консультант. Для нормальной жизнедеятельности каждому человеку необходимо в день около 2 литров питьевой воды. Это значит, что население нашей страны выпивает ежедневно около 0,5 млн. тонн воды. Огромное её количество потребляют и растения. Подсчитано, что для получения 1 тонны пшеницы нужно около 1500 т воды, хлопчатника – 10000 т. Большая часть этой воды, оставив растению растворённые в ней соли, испаряется листьями, давая атмосфере столько воды, сколько её унесут все реки Земли. Лишь 1,5–2 % поступающей в растения воды расходуется в процессе фотосинтеза. Это составляет около 650 млрд. т воды в год. Земля накопила бы воды в гидросфере за 2,5–3 млрд. лет. Но если бы вода, используемая при фотосинтезе, не возвращалась растениями в окружающую среду, то всего через 2 млн. лет эти запасы полностью “высушили” бы нашу планету (слайд 30).
Девятый консультант. Области применения воды настолько обширны, что практически невозможно назвать какой-либо производственный процесс, в котором не используется вода. Промышленность нашей страны ежесекундно использует столько воды, сколько несёт её Волга.
Второй консультант. Запасы пресной воды, содержащей до 0,05% солей, составляют примерно 2% гидросферы. Доступна для использования лишь малая её часть (по некоторым подсчётам, всего около 20000 км3/год). Поэтому особое значение приобретает бережное расходование воды и решение проблем её очистки (слайд 31).
Учитель. Беречь воду — это значит беречь Жизнь, здоровье человека и Окружающей среды. Каждому из вас я хочу подарить цветок, но цветок необыкновенный. Мы его назовём “Цветок Жизни” (слайд 32). (Учитель раздаёт заранее вырезанные из бумаги цветы). На его лепестках вы напишите, что, по-вашему, нужно сделать, чтобы на Земле всегда была вода: чистая, тёплая, звонкая.
Учащиеся на лепестках цветов пишут свои предложения — что и как нужно делать, чтобы беречь воду.
Учитель дополняет рассуждения учеников сведениями о необходимости строго соблюдать закон “Об охране и рациональном использовании природных ресурсов”.
Учитель. И всё же эта молекула воды продолжает хранить в себе какое-то волшебство. В 1929 году английский писатель Дэвид Герберт Лоуренс выразил это так: “Вода (Н2О) — две части водорода и одна часть кислорода, — но остаётся ещё нечто третье, составляющее сущность воды, и никто не знает, что это такое”.
Учитель оценивает всех учащихся – консультантов, а также тех, кто участвовал в дискуссии. Все учащиеся сдают учителю свои “Цветы Жизни”
Дополнительные сведения
- При падении капли воды на твёрдую поверхность, у неё внутри взрывается воздушный пузырь, и вверх выстреливает маленький фонтан со скоростью до 20 м/с.
- Воду, в литре которой содержится не более 5 г солей, можно пить без ограничений.
- Вода, как утверждает японец Масару Эмото, реагирует на музыку, молитвы и литературу, образуя красивые, правильные формы, или же совершенно бесформенные кристаллы.
- В океанах и ледовых покровах содержится 1,4 триллиона воды.
- Учёные сделали вывод, что от комет происходит максимум 50 % земной воды, вероятнее же всего, — лишь 10 %.
- Во Вселенной очень много воды, но в основном в виде льда. На спутнике Юпитера (Ганимеде) — это слой толщиной в несколько сотен километров. На другом спутнике, Европе, — ледовый океан глубиной около 200 км.
Клаус Бахманн
“Вода: загадочная родина жизни”
Журнал GEO, № 1 январь 2008 (слайд 33).
Домашнее задание: Подготовьте небольшое устное сообщение на тему: “Можно ли считать, что теперь мы всё знаем о воде?” (слайд 34).
Урок 2. Приложение 1
Урок 3. Приложение 2