Влияние примесей на сопротивление в жидких растворах вообще мало изучено или отсутствуют в справочниках. Отсутствуют данные о сопротивлении некоторых сильных и слабых растворов образующихся на основе питьевой воды и на основе моющих средств.
Ежегодно в России выпускаются или завозятся различные контрафактные виды моющих средств, на которых написан приближенный состав, из которого оно изготовлено. Применение некоторых таких средств пагубно сказывается на здоровье людей, которые часто пользуются этими средствами дома и на работе, не соблюдая технику безопасности. Такие моющие средства могут попадать в организм человека и кожу, что вызывает зуд, шелушение, раздражение эпидермиса и даже рвоту, приводя к летальному исходу. Поэтому вопрос качества товара остается актуальным. Один из экспресс-методов оценки качества – это оценка показателя преломления с помощью метода рефрактометрии. Для измерения электрического сопротивления использовали мостовой метод – мост Уинстона
В связи с этим была поставлена цель и задача – провести исследования по изучению зависимости сопротивления питьевой воды и моющих средств от концентрации различных видов примеси.
Основные результаты исследований следующие. В работе измерены сопротивления слабых и сильных растворов. Обнаружено, что с увеличением концентрации примесей, образующих слабые растворы в питьевой воде – ее сопротивление растет, а с примесями, образующими сильные растворы – сопротивление уменьшается. Также в измерены сопротивления моющих средств с добавками примесей образующие слабые растворы. Обнаружено, что с увеличением концентрации примесей спирта и глицерина, образующих слабые раствор, в моющие средства, их сопротивление также растет.
Такое поведение зависимости сопротивлении от концентрации связано со структурными изменениями в моющих средствах, приводящее к изменению вязкости и поверхностного натяжения.
Введение. Носителями заряда в жидкостях являются ионы, т.к. электроны легко прилипают к нейтральным молекулам жидкости и не могут существовать в свободном состоянии. Кроме того, в жидкости заряды могут переноситься ионами, частицами и даже пузырьками.
Ионизироваться могут молекулы основной жидкости, или примесей, т.е. имеющие преимущественно ионную связь между частями молекулы. Характерный пример – молекула NaCl, которую можно представить состоящей из ионов Na+ и Cl-. В жидкости молекула NaCl может растворяться и существовать сразу в виде ионов, либо ионных пар (Na+Cl-) [1].
Наиболее важным видом электролитов являются водные электролиты, т.к. вода является самым распространенным жидким веществом, она считается самым сильным растворителем и самой сильной ионизирующей средой [2].
Условно все вещества, растворенные в жидкости и частично диссоциирующие на ионы, делят на два типа: сильные и слабые электролиты. Сильные электролиты – вещества, полностью диссоциирующие на ионы. Это соли типа NaCl, сильные кислоты типа HCl. Слабые электролиты – малодиссоциирующие вещества, т.е. они, растворяются в виде молекул, только малая часть молекул диссоциируют на ионы. Пример – спирты, органические кислоты (например, уксусная кислота). Число ионов зависит от концентрации растворенных веществ.
За счет большой растворяющей способности воды, обычно электропроводность влажных сред оказывается достаточно великой, т.к. растворенные вещества зачастую содержат сильно диссоциирующие соли. Причиной электропроводности увлажненных диэлектриков является растворение в воде различных примесей и их последующая диссоциация на ионы.
Влияние примесей на сопротивление в жидких растворах вообще изучено пока недостаточно. Отсутствуют данные о сопротивлении некоторых растворов сильных (с примесями: поваренной соли, медного купороса, некоторых моющих средств) и слабых (с примесями: сахара, спирта, глицерина) растворов образующихся на основе питьевой воды и на основе моющих средств.
В связи с этим была поставлена цель и задача – провести исследования по изучению зависимости сопротивления питьевой воды и моющих средств от концентрации различных видов примеси.
Обзор литературы показывает, что жидкие растворы на основе спиртов, моющих средств, глицерин и др. не полностью изучены либо отсутствуют физико-химические характеристики (например, проводимость электрического тока, сопротивление, зависимость проводимости и сопротивления от температуры и т.д.), в частности влияние моющих средств на показатель преломления глицерина и наоборот.
В работе [3] приводятся результаты исследования концентрации примесей на сопротивления твердых растворов на основе In, Sn и Pb, в качестве примесей использовались металлы: Zn, In, Pb, Sn, Aq, Na, Li, Cd, Ca, Mg, Ba. Показано, что малые добавки примесей повышают сопротивление твердых растворов по линейному закону, независимо от типа примеси.
Вместе с тем знание концентрационных зависимостей сопротивления и показателя преломления позволяют по сопротивлению и показателю преломления позволяют контролировать состав жидких растворов. Подобные экспресс-методы позволяют оптимизировать методику выявления контрафактной продукции.
Материалы и методика эксперимента. Для измерения электрического сопротивления использовали компенсационный метод, который описан в работе [4], точность наших измерений составлял 0,001. Приготовленные растворы наливали в ванну для измерения сопротивления. Измерения проводились для 100 г раствора при постоянном напряжении 2 В для всех опытов. Напряжение не поднимали выше 2 В во избежания нагрева раствора. Измерения проводились при комнатной температуре.
Нами были использованы для получения растворов следующие примеси: медный купорос и поваренная соль (для получения активного раствора); спирт и сахар (для получения слабого раствора); моющие средства («Утенок 5 в 1», «Шумовит», «Мастер блеск», «Vanish», «Mr. Proper», «Доместос», «Fairy»).
Результаты измерений и их обсуждение. Результаты измерения сопротивления жидких растворов представлены на рис. 1–5. Из рис. 1–3 видно, что примеси йода, поваренная соль, медный купорос, моющие средства, образуют сильные растворы (рис. 1, 3), с увеличением концентрации уменьшают сопротивление водного раствора, а спирт и сахар образуют слабые растворы, с увеличением концентрации наоборот увеличивают сопротивление (рис. 2).
Моющее средство «Утенок 5 в 1» содержит соляную кислоту, поэтому ее добавка сильно уменьшает сопротивление, увеличивая тем самым протекающий через раствор ток.
Нами также были проведены исследования по выявлению зависимости сопротивления некоторых моющих средств от концентрации некоторых примесей. Результаты исследования приводятся на рис. 4, 5.
Как видно из рис. 4, добавление глицерина в моющее средство (до 2 %) увеличивает его сопротивление, при увеличении концентрации до 4 % сопротивление раствора уменьшается. При увеличении концентрации от 6 % до 40 % сопротивление раствора увеличивается, достигая максимума. При концентрации глицерина С >50 % происходит насыщение раствора при котором сопротивление не меняется и остается неизменным.
Визуально обнаружено, что вязкость моющего средства сначала увеличивается при добавлении глицерина (до 2 %) превращаясь в «желе» подобное состояние, а при дальнейшем добавление глицерина в моющее средство вязкость уменьшаться, превращаясь в жидкость.
Из рис. 5 видно, что увеличение концентрации спирта или глицерина от 0 до 30%. в моющем средстве «Discover» их сопротивления увеличиваются линейно от 70 до 110 Ом. Следует отметить, что сопротивление раствора «Discover» + глицерин растет чуть быстрее, чем раствор «Discover» + спирт.
Также линейно растет сопротивление раствора полученного при добавлении глицерина в жидкое мыло «Palmolive». Здесь изменение концентрации примеси от 0 до 30% приводит к увеличению сопротивления от 140 до 235 Ом.
Увеличение сопротивления можно объяснить следующим образом, что в процессе образования названных растворов имеет место рекомбинации, т.е. происходит захват ионами электронов. Следует отметить, что названные примеси уменьшают число свободных носителей зарядов в полученных растворах.
Таким образом, полученные нами растворы оказались слабыми растворами (электролитами), которые слабо диссоцируются на ионы.
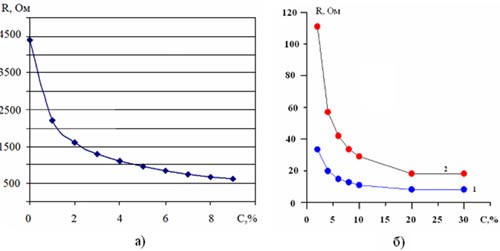
Рис. 1. График зависимости сопротивления R питьевой воды от концентрации примеси
а) 5% йода; б) 1 – поваренная соль; 2 – медный купорос.
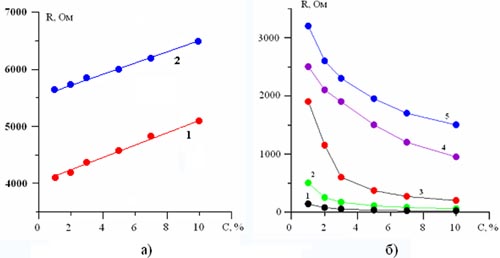
Рис. 2. График зависимости сопротивления R питьевой воды от концентрации примеси:
а) 1 – спирт; 2 – сахар;
б) 1 – Утенок 5 в 1; 2 – Шумовит; 3 – Мастер блеск, 4 – Vanish; 5 – Mr.Proper.
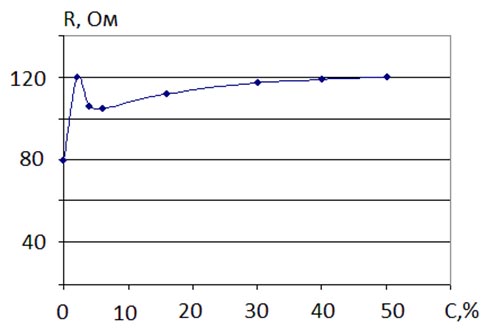
Рис.3. Зависимость сопротивления моющего средства «Domestos» от концентрации глицерина.
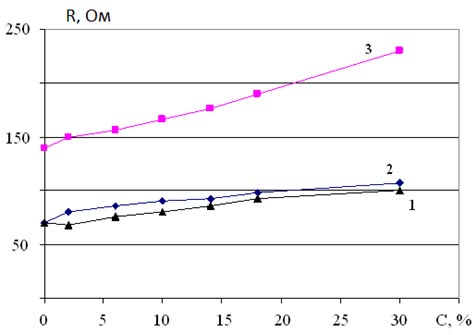
Рис. 4. Зависимость сопротивления моющего средства от концентрации:
1 – шампунь «Discover» + спирт; 2 – шампунь «Discover» + глицерин;
3 – жидкое мыло «Palmolive» + глицерин.
Выводы.
1. В работе измерены сопротивления слабых и сильных растворов. Обнаружено, что с увеличением концентрации примесей, образующих слабые растворы в питьевой воде – ее сопротивление растет, а с примесями, образующими сильные растворы – сопротивление уменьшается.
2. Также в измерены сопротивления моющих средств с добавками примесей образующие слабые растворы. Обнаружено, что с увеличением концентрации примесей спирта и глицерина, образующих слабые раствор, в моющие средства, их сопротивление также растет.
Такое поведение зависимости сопротивлении от концентрации связано со структурными изменениями в моющих средствах, приводящее к изменению вязкости и поверхностного натяжения.
Литература
- Остроумов С. А. Биологические эффекты при воздействии поверхностно-активных веществ на организмы. – М.: МАКС – Пресс, 2001. – 334 с.
- Ставская С. С., Удод В. М., Таранова Л. А., Кривец И. А. Микробиологическая очистка воды от поверхностно-активных веществ. – Киев: Наук. Думка, 1988. – 184 с.
- Ахкубеков А.А., Орквасов Т.А., Созаев В.А.. Контактное плавление металлов и наноструктур на их основе. М.: Физматлит, 2008. – 152 с.
- Шидов Х.Т., Темукуев И.М., Орквасов Т.А. Лабораторный практикум по электромагнетизму. – Каб. – Балк. ун. – т., 2002 г. – 88.