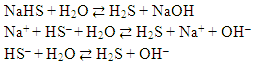Цели:
- Образовательные:
- сформировать представление о гидролизе, сущности гидролиза солей;
- научить ребят составлять уравнения реакций гидролиза солей в молекулярном и ионном виде;
- учить определять реакцию и тип среды раствора электролита на основании состава соли;
- продолжить развивать умения работать с таблицами, справочными материалами.
- Развивающие:
- на примере свойств солей, различной природы, их отношение к воде, продолжить развитие умений наблюдать, сравнивать изучаемые явления, выявлять причинно-следственные связи, делать соответствующие выводы.
- Воспитательные:
- совершенствовать коммуникативные умения в ходе коллективного обсуждения;
- развивать умение формулировать и аргументировать собственное мнение, развивать самостоятельность.
Оборудование и реактивы: таблицы «Окраска индикаторов», «Растворимость солей, кислот и оснований в воде»; таблица сильных и слабых электролитов; алгоритм составления уравнений реакций гидролиза солей; проектор, компьютерный класс (на каждом компьютере установлена заранее компьютерная программа – тест по теме «Гидролиз солей»).
ХОД УРОКА
I. Организационный момент
II. Подготовки к восприятию нового материала, актуализация знаний и опыта
Как и любой вопрос, имеющий большое практическое значение и применение, гидролиз основан на теории, а именно теории протекания химических явлений, теории растворов. Поэтому мы должны повторить основные идеи и понятия, имеющие непосредственное отношение к теме урока.
Индивидуальный опрос учащихся по вопросам домашнего задания:
Выполнение тестовых заданий.
- Электролитическая диссоциация. Слайд № 2
- Электролиты и неэлектролиты. Слайд № 3
- Сильные и слабые электролиты. Слайд № 4
- Составление уравнений диссоциации.
Далее напоминаю учащимся, что различают три типа сред: нейтральную, щелочную и кислую. В нейтральной среде концентрации ионов водорода и гидроксид-ионов равны:
[H+] = [OH–] = 10–7 моль/л, pH = 7
В кислой среде концентрация ионов водорода больше концентрации гидроксид-ионов:
[H+] > [OH–] = 10–7 моль/л, pH < 7
В щелочной среде концентрация ионов водорода меньше концентрации гидроксид-ионов:
[H+] < [OH–] = 10–7 моль/л, pH > 7
Реакция чистой воды является нейтральной (рН = 7). Водные растворы кислот и оснований имеют соответственно кислую (рН < 7) и щелочную (рН > 7) реакцию. Слайд 5
Как известно, присутствие в растворе кислот и оснований можно обнаружить с помощью индикаторов. Например, лакмус в растворе краснеет, а в растворе основания – синеет. Изменение окраски индикатора вызвано присутствием в растворе кислоты ионов Н+, а в растворе основания – ионов ОН–. Казалось бы, в растворах солей, при диссоциации которых не образуется ни ионов Н+, ни ионов ОН–, окраска индикаторов меняться не должна. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь – нейтральную, щелочную или кислую реакцию.
Учитель: Почему растворы солей
изменяют фиолетовую окраску раствора лакмуса на
красную?
Учащийся: Значит, в этих растворах есть
ионы H+.
Учитель: Откуда ионы H+ в растворе,
если вы смешивали соль и воду?
Учащийся: Наверное, из воды.
Учитель: Как от воды могли отделиться
ионы H+?
Учащийся: Видимо, какая-то частица соли
отрывает от молекулы воды частицу OH–.
Отрицательную частицу от молекулы воды может
оторвать положительная частица из соли.
Учитель: Что же общего у катионов Cu2+,
Zn2+, Al3+? Почему именно они
присоединяют гидроксид-ионы? Почему этого не
происходит в случае катионов Ba2+, K+?
Учащийся: Гидроксиды Сu(OH)2, Zn(OH)2,
Al(OH)3 – cлабые основания, а Ba(OH)2, KOH –
сильные. Сильные основания в растворе полностью
диссоциируют на ионы.
Затем вспоминаем, что любую соль можно
представить как продукт взаимодействия
основания с кислотой. Например, соль Na2CO3
образована сильным основанием NaОН и слабой
кислотой H2CO3. Далее, используя
таблицы, разбираемся, какими кислотами и
основаниями образованы соли, например, NН4NO3,
CH3COONH4, NaCl.(Слайд 6)
III. Изучение нового материала
Гидролизом называется процесс
взаимодействия вещества с водой. (Слайд 6)
Причиной гидролиза является электролитическая
диссоциация соответствующих солей и воды. Вода
незначительно диссоциирует на ионы Н+ и ОН–,
но в процессе гидролиза один или оба из этих
ионов могут связываться ионами, образующимися
при диссоциации соли, в малодиссоциированные,
летучие или труднорастворимые соединения
(молекулы или сложные ионы). Происходит
изменение реакции среды.
Гидролиз идет по-разному в зависимости от силы
кислоты и основания, образовавших соль.
Гидролизу подвергаются только те соли, которые
образуют при диссоциации ион от слабого
электролита. Соли, образованные сильными
основаниями и сильными кислотами гидролизу не
подвергаются. Таким образом, возможность
протекания гидролиза соли определяется наличием
иона от слабого электролита.
Соли, образованные слабым основанием и слабой
кислотой, гидролизуются практически полностью, а
в других случаях гидролиз идет незначительно.
Соли многоосновных кислот и многокислотных
оснований гидролизуются ступенчато, образуя при
этом кислые и основные соли. Практическое
значение обычно имеет только процесс, идущий по
первой ступени, которым, как правило, и
ограничиваются при оценке гидролиза солей (один
моль ион слабого электролита взаимодействует
только с одним молем молекул воды).
Реакцию среды при гидролизе определяет ион сильного электролита. (Слайд 7)
Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможно три типа гидролиза:
- гидролиз по катиону (в реакцию с водой вступает только катион), соль образована сильной кислотой и слабым основанием
- гидролиз по аниону (в реакцию с водой вступает только анион), соль образована слабой кислотой и сильным основанием
- совместный гидролиз – гидролиз по катиону и по аниону (в реакцию с водой вступает и катион, и анион), соль образована слабой кислотой и слабым основанием
Рассмотрим различные случаи.
1) Гидролиз соль образованой сильным основанием и слабой кислотой Na2CO3 (гидролиз по аниону). Слайд 8.
Гидролиз по аниону разбираем аналогично, записываем уравнение:
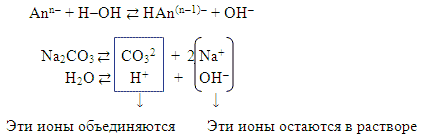
Полное ионное уравнение происходящего процесса гидролиза:
![]()
Сокращенное ионное уравнение:
![]()
Вывод:
а) в растворе есть свободные гидроксид-ионы ОН–
и концентрация их больше, чем в чистой воде,
поэтому раствор карбоната натрия имеет щелочную
среду (pH > 7),
б) с водой связываются анионы CO32– ,
т.е. гидролиз идет по аниону
В том случае, когда соль образована слабой многоосновной кислотой и сильным основанием, гидролиз по аниону протекает ступенчато и число ступеней гидролиза зависит от основности слабой кислоты. На первых ступенях гидролиза образуется кислая соль (вместо кислоты) и сильное основание.
Например, при гидролизе Na2S , первая ступень имеет вид:
Затем в реакцию обменного взаимодействия с водой вступает гидросульфид-ион:
Следует обратить внимание, что количественно вторая ступень гидролиза протекает в несравнимо меньшей степени, чем первая. Поэтому в ответе, при сдаче ЕГЭ, достаточно указать уравнение только для первой ступени:
2) Гидролиз соли образованной слабым основанием и сильной кислотой NH4NO3 (гидролиз по катиону). Слайд 8.
Как катион соли может взаимодействовать с
водой?
Отмечаем, что катион это положительная частица, а
молекула воды полярна, условно можно представить
ее состоящей из положительно поляризованного
атома водорода и отрицательно поляризованной
гидроксильной группы.
Какую же часть молекулы воды оторвет и
присоединит к себе катион?
Ответ учащегося: «Катион присоединит
гидроксильную группу».
Ответ подтверждаем записью уравнения, отмечая
обратимость реакции:
Написав формулу образовавшейся частицы, тут же
обсуждаем, что это за частица, будет ли она иметь
заряд и какой, приходим к выводу, что, как правило,
это гидроксокатион. А что останется от молекулы
воды? Какую реакцию водного раствора
обуславливает избыток этих частиц? Какова будет
реакция индикатора? А теперь проверим нашу
гипотезу (демонстрация опыта). Слайд.
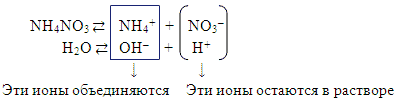
Полное ионное уравнение происходящего процесса гидролиза:
Сокращенное ионное уравнение:
Вывод:
а) в растворе есть свободные ионы H+ и
концентрация их больше, чем в чистой воде,
поэтому раствор нитрата аммония имеет кислую
среду (рН < 7),
б) с водой связываются катионы аммония NH4+,т.е.
гидролиз идет по катиону
Если соль образована слабым многокислотным основанием и сильной кислотой, катионный гидролиз протекает cтупенчато в зависимости от кислотности слабого основания. Вместо основания на первых ступенях такого гидролиза образуется основная соль, например:
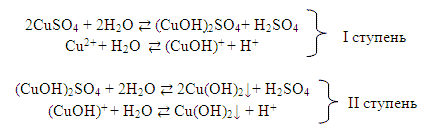
Гидролиз по второй ступени практически не протекает, так как накапливающиеся ионы Н+ препятствуют прохождению гидролиза по II ступени.
3) Гидролиз соли образованой слабым основанием и слабой кислотой CH3COONH4 (гидролиз по катиону и по аниону). Слайд 8.
Какого типа солям относятся, в основном, соли аммония. В этом случае продуктами гидролиза являются слабые кислота и основание:
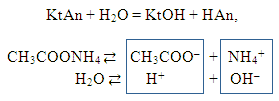
Полное ионное уравнение происходящего процесса гидролиза:
В этом случае образуются два
малодиссоциированных соединения, CH3COOH и NH4OH,
pH раствора зависит от относительной силы кислоты
и основания, т.е. водные растворы таких солей
могут иметь нейтральную, слабокислую или
слабощелочную реакцию в зависимости от констант
диссоциации образующихся кислот и оснований.
Реакция раствора соли CH3COONH4 –
нейтральная (pH = 7), потому что КД(NH4OH) = КД(CH3COOH)
(КД(NH4OH) =1,8 • 10–5 и КД(CH3COOH) = 1,8 •
10–5)
Вывод:
а) ионы, определяющие среду Н+ и ОН–,
находятся в растворе в равных количествах, и
среда будет нейтральной.
б) с водой связываются анионы CH3COO– и
катионы NH4+, т.е. гидролиз идет и по
катиону и по аниону
В большинстве случаев гидролиз является обратимым процессом, но некоторые из солей, образованные очень слабым основанием и очень слабой кислотой подвергаются необратимому гидролизу. Например, полному гидролизу подвергаются сульфиды и карбонаты трехзарядных катионов Al3+, Fe3+ Cr3+:
![]()
Поэтому сульфиды этих элементов могут быть получены только сухим путем.
4) Соль, образованная сильным основанием и сильной кислотой NaCl. Слайд 8.
Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос с учениками, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут, следовательно, в реакцию гидролиза не вступают. NaCl гидролизу не подвергается.
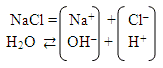
IV. Закрепление и первичная проверка полученных знаний
Этап занятия закрепления изученного материала проводится в виде работы с обучающей компьютерной программой «Гидролиз солей». Каждый учащийся выполняет тест.
V. Подведение итогов
В заключение урока, отмечам, что в рамках школьного курса в реакциях гидролиза солей нет ничего чрезмерно сложного для понимания. Здесь используются общие правила написания ионных уравнений, общие представления о смещении химического равновесия, общий поход к номенклатуре солей, краткий и удобный алгоритм написания уравнений. Хочется надеяться, что изложенный материал поможет вам при подготовке и сдаче ЕГЭ.
Подводится итог результатов работы учащихся на уроке с аргументацией поставленных оценок: пояснением активности их работы, правильности ответов и уровня сложности задания.
VI. Домашнее задание. §16, с.163-173
ЛИТЕРАТУРА
- Габриелян О.С. «Химия» 11 класс. Учебник для общеобразовательных учебных заведений. О.С. Габриелян, Г.Г. Лысова.: М., Дрофа. 2005.
- Комаровский А.Н. Россошанская школа-интернат Воронежская обл. Тестирование в MSPowerPoint http://www.rosinka.vrn.ru/pp/
- Каверина А.А., Корощенко А.С., Медведев Ю.Н. ЕГЭ 2011. Химия. Универсальные материалы для подготовки учащихся. М.: Интеллект-Центр, 2011. – 320 с.
- Лидин Р.А, Молочко В.А., Андреева Л.Л. Химия для школьников старших классов и поступающих в вузы. М.: Дрофа. 2005.