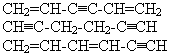Цели урока:
- Общеобразовательные: формирование мышления учащихся через активизацию представлений о взаимосвязи строения вещества с его свойствами, ознакомление учащихся с историей открытия бензола, его физическими и химическими свойствами, способами получения. Дать понятие об ароматичности, ароматической связи. Ознакомить с современной теорией электронного строения бензола.
- Развивающие: развитие умений и навыков работы с ноутбуком, с электронными изданиями, развитие познавательного интереса учащихся, повышение интеллекта.
- Воспитательные: формирование научного мировоззрения, воспитание умения работать в парах, чувства гордости за достижения науки, привитие интереса к предмету.
Оборудование: шаростержневая модель молекулы бензола, ноутбуки на каждой парте, интерактивное оборудование, СD "Виртуальная лаборатория", листы для тестирования, смайлики.
Ход урока
I. Организационный момент
Приветствие, проверка готовности учащихся к уроку, создание положительной мотивации на предстоящий урок.
II. Повторение пройденных тем (фронтальный опрос, работа учащихся у доски)
- Дать определение предельным и непредельным углеводородам, охарактеризовать классификацию веществ;
- Алканы, алкены, алкины: сравнить тип гибридизации, валентный угол, длину связи;
- Назвать типы химических реакций для углеводородов;
- Написать уравнения характерных реакций для углеводородов.
III. Изложение новой темы
- введение
- немного истории
- о названии...
- решение задачи на определение молекулярной формулы вещества
- способы получения бензола
- физические свойства бензола
- воздействие на организм человека
- строение бензола - структурная формула
- современная теория электронного строения бензола
- химические свойства бензола
- применение бензола
ФЛИПЧАРТ (1, 2, 3)

Какие ассоциации вызывают эти слайды?
Представьте себе Англию начала 19 века. Уже в 1814 году улицы и набережные Лондона по вечерам освещались газовыми фонарями. В специальных горелках уличных фонарей сжигали светильный газ, получаемый из китового и трескового жира. Но не все жители туманного Альбиона были довольны новым освещением. Вальтер Скотт писал: "Мир перевернулся, Лондон будет освещаться угольным дымом". А производители свечей открыто громили новые фонари. К тому же у "светильного газа" имелся существенный недостаток: в летние ночи освещение было ярким, а зимой в сильные холода быстро становилось тусклым. Газ не давал яркого света, поэтому жителям Лондона не так приятно было гулять по набережной Темзы. Владельцы газового завода обратились за помощью к известному учёному М. Фарадею.
В 1825 году Фарадей установил, что часть светильного газа собирается на дне баллона в виде прозрачной жидкости. Учёный установил качественный и количественный состав этого вещества и назвал его "карбюрированным водородом", поскольку в его состав входили атомы углерода и водорода. Название нового вещества несколько раз менялось. Эйльгард Митчерлих назвал его бензином. Вскоре Юстус Либих переименовал его в бензол (от араб.ben-аромат+zoa-сок+лат.ol(eum)-масло). В 1837 году с подачи Огюста Лорана появилось ещё одно название-фен (от греч.phenix-освещать) в знак того, что бензол был обнаружен в светильном газе.
Итак, это вещество - бензол!
Сегодня без него не обходятся при получении многих лекарственных препаратов, душистых веществ, разнообразных красителей. Оно применяется как растворитель, как добавка к моторному топливу. Велика роль производных бензола в сельском хозяйстве при условии их рационального применения. И хотя нам практически не приходится иметь дело с ним, его производные - аспирин, ванилин, эфедрин и другие - давно уже вошли в нашу жизнь.
Среди более 25 млн. известных на сегодняшний день органических соединений немного найдётся таких, которые оказали на развитие органической химии большее влияние, чем бензол! Для объяснения его строения и свойств было выдвинуто множество теорий, большинство из которых не выдержали испытания временем и известны лишь историкам химии.
Бензол в органической химии является таким же важным веществом, как и серная кислота в неорганической химии. И если последняя известна химикам ещё с древнейших времён, то бензол был открыт лишь в начале 19 века, на заре рождения новой химии - именно той, которая лидирует в наши дни, той, с которой связано появление различных полимеров, искусственных тканей, волокон, синтетических красителей, именно той, которая так круто изменила нашу жизнь к лучшему.
А путь к многообразию продуктов химии лежит именно через бензол - ничем не примечательную жидкость, которой и название дали не сразу, формулу не могли определить, а строение было загадкой и предметом многочисленных научных дискуссий!
Задача: Определить формулу вещества, открытое Фарадеем, если известно, что в его состав входит 92, 3% углерода и 7,7% водорода, а относительная молекулярная масса вещества равна 78.
ФЛИПЧАРТ (8)

СЛАЙД № 1
Итак, С6 Н6-бензол-легкокипящая, бесцветная, нерастворимая в воде жидкость со своеобразным запахом.
Многие производные бензола также обладают приятным ароматом, иногда очень приятным, поэтому эти углеводороды назвали "ароматическими" (по предложению А.Кекуле-1860 г). Позднее оказалось, что большинство веществ, которые по строению и по свойствам принадлежат к этой же группе, не имеют ароматного запаха, однако исторически сложившееся название этих соединений сохранилось до наших дней. Бензол по праву можно считать родоначальником этих соединений.
Бензол оказывает вредное воздействие на организм человека: вызывает поражение кровеносной и нервной систем, желудочно-кишечного тракта. Он является канцерогеном, т.е. веществом, которое при многократном контакте с организмом способствует росту злокачественных опухолей. Особенно сильно это влияние на молодой организм. Таким образом, несмотря на огромное значение бензола и его соединений в жизни людей, он способен принести человеку вред!
По содержанию в молекуле атомов водорода было ясно, что ароматические углеводороды имеют непредельный характер. На бензол и полученные вскоре его гомологи был обрушен весь имеющийся арсенал методов исследования, как химических, так и физических. К всеобщему удивлению, вещество не обладало склонностью к реакциям присоединения, т.е.не напоминало алкены, а по характерным для него реакциям замещения походило скорей на алканы. Началась увлекательная история установления структурной формулы бензола.
Впервые наличие цикла в бензоле предположил в 1861 году австрийский учёный Иоганн Лошмидт. В 1865 году немецкий химик-органик Фридрих Август Кекуле предложил свою формулу бензола с чередующимися двойными и одинарными связями в шестичленном цикле.
Учитывая общую формулу бензола и его сильно ненасыщенный характер, можно составить такие структурные изомеры:
Но какая же из них соответствует истине? Ф.А.Кекуле долго размышлял над структурой бензола. Однажды ему пришлось быть свидетелем в судебном процессе по делу об убийстве графини Герлиц. На этом процессе в качестве улики демонстрировалось кольцо графини в виде двух переплетённых змеек. Эти змейки врезались в память учёного.
Из воспоминаний Ф.А. Кекуле: "Моя лаборатория находилась в переулочке, и даже днём там царил полумрак. Для химика, который проводит целые дни в лаборатории, это не было помехой. Я занимался работой над своим учебником, но что-то мне мешало, и мои мысли где-то витали. Я повернул кресло к камину и задремал. Атомы углерода и водорода принялись танцевать перед моими глазами...Длинные нити очень часто сближались и свёртывались в трубку, напоминая двух змей. Но что это? Одна из них вцепилась в собственный хвост, продолжая насмешливо кружиться перед моими глазами. Я внезапно пробудился и на этот раз провёл остаток ночи, чтобы изучить следствие из моей гипотезы".
Сон оказался вещим! Кекуле сцепил все атомы углерода в шестиугольник с чередующимися двойными и одинарными связями.
СЛАЙД № 5
Так была предложена структурная формула бензола. Более 100 лет пользуются химики формулой Кекуле, хотя она противоречива. Многочисленные факты подталкивали химиков к мысли, что в бензоле нет ни простых, ни двойных связей, а есть " полуторные". Это предложил И.Тиле уже на рубеже IX и XX вв. Он утверждал, что атомы углерода соединены простыми связями, а остаточные валентности равномерно распределяются по всему кольцу. Девять валентностей приходится на шесть атомов - вот и получается, что связи в молекуле бензола - "полуторные". После этого формулу бензола стали изображать в виде шестиугольника с кольцом.
Такое изображение оказалось более чем правильным. С помощью сложных физических наблюдений было установлено, что шесть электронов от "лишних" связей (по два на одну связь) образуют единую структуру: т.н "единое электронное облако", которое и стало признаком ароматичности соединения. И почти вековое исследование бензола завершилось...
Изучением природы двойных связей в бензоле занимались многие выдающиеся химики, постепенно приближаясь к пониманию истинного строения его молекулы. Современное представление об электронной природе связей в бензоле основывается на гипотезе выдающегося американского физика и химика Лайнуса Полинга, дважды лауреата Нобелевской премии. Именно по его предложению молекулу бензола стали изображать в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
Кекуле оказался прав: молекула бензола имеет циклическое строение, все шесть атомов углерода лежат в одной плоскости. Каждый атом углерода находится в состоянии sp2 - гибридизации, поскольку связан с ещё двумя атомами углерода и одним атомом водорода.
Кроме этого, у каждого атома углерода есть одна p-орбиталь, не участвующая в гибридизации. Она имеет форму объёмной восьмёрки. Шесть таких электронных облаков перекрываются, образуя единую П-систему, в которой электронная плотность равномерно распределена между всеми шестью атомами углерода, а следовательно, все связи между атомами углерода совершенно одинаковые.
В связи с этим более точным изображением бензола является шестиугольник с окружностью внутри.
СЛАЙД № 6
(Учащимся предлагается работа с CD "Виртуальная лаборатория", раздел "Конструктор молекул". Учащиеся собирают динамичные,трёхмерные модели молекулы бензола, рассматривают структурную модель, модель с гибридными облаками.)
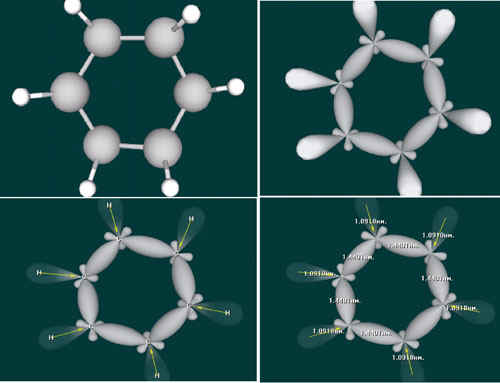
РИС. 1
Физминутка для глаз после работы с ноутбуками.(приложение 1)
По химическим свойствам бензол занимает промежуточное положение между алканами и алкенами. Так сказываются на свойствах бензола особенности его электронного строения.
Бензол не обесцвечивает раствор перманганата калия. К бензолу может присоединиться хлор, но реакция протекает только при интенсивном облучении смеси.
СЛАЙД № 8
Реакция присоединения водорода к бензолу протекает под давлением и при нагревании.
СЛАЙД № 9
Таким образом, реакции присоединения у бензола протекают трудней, чем у алкенов.
А реакции замещения протекают легче, чем у алканов.
СЛАЙД № 10,11
Бензол - важнейшее сырьё для химической промышленности, поскольку он используется и как исходный реагент (практически все современные синтетические материалы, как правило, содержат ароматические группировки), и как растворитель для других веществ( бензол растворяет практически все органические соединения, это своего рода "органическая вода"). Вот только основные синтезы с участием бензола: получение фенола, бензойной кислоты, анилина, фенолформальдегидной смолы, специальных видов каучука, толуола, а, следовательно, и взрывчатых веществ(тринитротолуола), лекарств(аспирина, например)... Перечислять можно очень долго.
Бензол и его производные находят широкое применение в народном хозяйстве.
Бензол служит исходным сырьём для синтеза многих органических соединений: лекарств, душистых веществ, красителей, растворителей, полимеров. Используется как добавка к моторному топливу для улучшения его свойств.
Хлорпроизводные бензола используются в сельском хозяйстве в качестве средств защиты растений, для сухого протравливания семян пшеницы и ржи против твёрдой головни, для борьбы с филлоксерой на виноградниках.
СЛАЙД № 12
IV. Закрепление
Вопросы для закрепления.
- Каковы физические свойства бензола?
- В чём заключается противоречие между структурной формулой бензола и его свойствами?
- Структурную формулу бензола изображают в виде шестиугольника с окружностью внутри. Что эта окружность означает?
- В чём заключается сходство бензола с алканами и алкенами?
V. Тестирование (приложение 2)
ФЛИПЧАРТ № 9
VI. Рефлексия
- Узнали много нового.
- Было интересно.
- Было над чем подумать.
- Поработали добросовестно.
- Урок понравился.
(Уходя с урока, ребята прикрепляют свои смайлики на магнитную доску)