Цели урока: Систематизация знаний учащихся об использовании кислот в повседневной жизни.
Задачи.
Образовательные. Обобщение знаний о химических свойствах веществ, применение знаний по химии на практике, закрепление навыков проведения эксперимента.
Воспитательные. Воспитывать умение работать в группах, оценивать свои возможности и знания учащихся.
Развивающие. Развитие логического мышления путём сравнения, обобщения, анализа, систематизации, развития познавательной и творческой деятельности.
Тип урока: обобщающий.
Вид урока: экспериментально-поисковый.
Методические приемы: презентация урока, исследовательская работа, работа в группах, работа с интерактивной доской.
Оборудование и реактивы: минеральная вода “Святой источник”, лакмус, магний, напиток “Кока Кола”, заранее очищенный раствор напитка, нитрат серебра, чистящее средство “Санокс”, раствор лекарства “Ацидин-пепсин”, лекарство ацетилсалициловая кислота (аспирин), хлорид железа (III), соляная кислота, карбонат натрия, вода, гидроксид натрия, сульфат меди (II), уксусная кислота, этиловый спирт, серная кислота, универсальная индикаторная бумага, колба, пробирки, держатель для пробирок, лучинка, спички, спиртовка, ступка с пестиком, ложечка для сыпучих веществ, стаканчик
Девиз урока."Мыслящий ум не чувствует себя счастливым, пока не удастся связать воедино разрозненные факты, им наблюдаемые".( Д.Хевеши) (Cлайд №1)
Ход урока
I. Актуализация опорных знаний. (Работа с интерактивной доской. Приложение 1)
Распределить кислоты по группам:
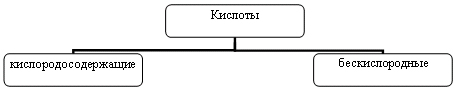
HCl, HBr, H2SO4, НСООН, HI, H2CO3,H2S, HNO3, H3PO4
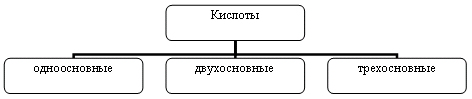
HNO3, HF, H3PO4, H2CO3, H2SO3,НООС-СООН, H2SO4, HNO2, H2СrO4, H2S, H2SiO3,
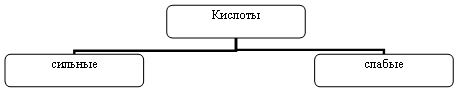
HNO3, H2S, H2SO4,. СН3СООН, H2CO3, HCl.
II. Изучение нового материала.
Учитель: Издавна люди научились применять для чистки изделий из цветных металлов подручные средства, причем некоторые из них не потеряли своего значения до сих пор. Например, для чистки бронзы в разных странах использовалось кислое молоко. На Руси для чистки самоваров применяли ягоды бузины, золу, мел, капустный рассол.
Тема нашего урока: “Человек в мире кислот”. (Слайд №2)
Цель нашего урока рассмотреть химические свойства кислот, на примере веществ окружающих нас в быту. (Слайд №3)
Сегодня вы работаете в группах, по ходу урока вы будете записывать результаты экспериментов в опорный конспект (Приложение 2), чтобы вместе сделать вывод о значении кислот (класс разбивается на 6 групп. Назначается командир группы, который оценивает участие каждого в работе, и в конце урока подает сведения учителю). А так же творческая группа должна будет проиллюстрировать результаты вашего исследования.
На нашем уроке будут проводиться опыты с кислотами, поэтому нам надо вспомнить правила техники безопасности. (Видеоролик о взаимодействии кислоты с сахаром, тканью, бумагой. Приложение 3) Какой можно сделать вывод после просмотра видеоролика?
Будьте предельно осторожны, берегите глаза! Кому понятны техника безопасности, название опыта, цель и ход работы поднимите руки. (Слайд №4)
В качестве напутствия я хотела бы привести слова Козьмы Пруткова: “Бросая в воду камешки, гляди на круги, ими образуемые, иначе такое бросание обратится пустою забавою…”. (Слайд №5)
Проводя опыт, сделайте выводы и найдите ответ на вопросы. (Слайд №6). Приложение 4
1 группа. Постановка эксперимента с минеральной водойРеактивы и оборудование: минеральная вода “Святой источник”, лакмус, магний, универсальная индикаторная бумага, колба, пробирки, держатель для пробирок, лучинка, спички, спиртовка.
Задание. Доказать наличие в минеральной воде угольной кислоты и объяснить ее свойства.
Ход работы
- В пробирку налить 2 мл минеральной воды и смочить ею универсальную индикаторную бумажку. Отметьте значение рН.
- В колбу налить 5 мл минеральной воды. Помешать 5-6 раз. Опустить в колбу зажженную лучинку. Что наблюдаете? Сделать вывод.
- В пробирку налить 2 мл минеральной воды и капнуть 1-2 капли лакмуса. Отметьте изменение цвета индикатора. Сделайте вывод.
- В пробирку налить 2 мл минеральной воды и капнуть 1-2 капли лакмуса Нагрейте пробирку с минеральной водой и лакмусом. (Соблюдайте правила по ТБ). Сравните полученные результаты с результатами 2 опыта. Как изменится окраска индикатора? Сделайте вывод. Составьте уравнение реакции.
- В пробирку насыпьте немного магния и добавьте 2 мл минеральной воды. Что наблюдаете? Сделайте вывод.
- Результаты исследования запишите в отчет.
Вопрос: Вреден углекислый газ для организма человека?
Предполагаемый ответ: Сам по себе углекислый газ безвреден, но надо помнить, что его присутствие в воде возбуждает желудочную секрецию, повышает кислотность желудочного сока и провоцирует метеоризм - обильное выделение газов. Может быть, поэтому на Западе потребитель все больше отдает предпочтение негазированной минералке. В растворенном состоянии углекислый газ химически активен, он вступает в соединение с различными элементами.
2 группа. Постановка эксперимента с “Кока Колой”
Реактивы и оборудование: напиток “Кока Кола”, заранее очищенный раствор напитка, нитрат серебра, универсальная индикаторная бумажка, пробирка, колба, лучинка.
Задание. Выявить, какие кислоты входят в состав напитка “Кока Кола”.
Ход работы
- В пробирку налить 2 мл напитка и смочить им универсальную индикаторную бумажку. Отметьте значение рН.
- В колбу налить 5 мл напитка. Помешать 5-6 раз. Опустить в колбу зажженную лучинку. Что наблюдаете? Сделайте вывод.
- В пробирку налить 1 мл очищенного напитка и добавить 1 мл нитрата серебра. Что наблюдаете? Сделайте вывод. Составьте уравнение реакции.
- Результаты исследования запишите в отчет.
Вопрос: Почему употреблять “Кока Колу” нельзя в больших количествах?
Предполагаемый ответ: В первые 10 минут: в организм поступает 10 чайных ложек сахара (максимальная рекомендуемая ежедневная доза ). В эту минуту вас не стошнит от избытка сахара потому что фосфорная кислота притупляет чрезмерную сладость, позволяя сахару усвоиться.
Через 20 минут: содержание сахара в крови увеличивается, что приводит к выбросу инсулина. Печень реагирует на это путем превращения сахара в жир.
Через 40 минут: поглощение кофеина завершилось. Расширяются зрачки, повышается артериальное давление, печень начинает выбрасывать больше сахара в кровь. Аденозиновые рецепторы мозга блокируются, тем самым, предотвращая сонливость.
Через 45 минут: усиливается выработка дофамина, гормона, стимулирующего центр удовольствия мозга. По такому же принципу действует героин.
Через час: Фосфорная кислота связывает кальций, магний и цинк в кишечнике, усиливая метаболизм. Увеличивается выделения кальция с мочой.
Более чем через час. Вступает в силу мочегонное действие кофеина, возникает потребность сходить в туалет. Выводятся кальций, магний и цинк, которые так необходимы для костей, так же как и натрий, электролит и вода. Вы становитесь раздражительным или вялым.
Фосфорная кислота добавляется в лимонады, мармелады. Ее можно узнать по значку Е 338. И если посмотреть на таблицу пищевых добавок, то там эту добавку можно найти среди действующих на желудочно-кишечный тракт.
3 группа. Постановка эксперимента с чистящем средством “Санокс”Реактивы и оборудование: чистящее средство “Санокс”, магний, карбонат натрия, вода, гидроксид натрия, сульфат меди (II), универсальная индикаторная бумага, пробирки, стаканчик.
Задание. Доказать, что в состав чистящего средства “Санокс” входит щавелевая кислота.
Ход работы
В стаканчик налить 10 мл средства и смочить им
универсальную индикаторную бумажку. Отметьте
значение рН.
Вопрос: В каких продуктах питания содержится щавелевая кислота и почему нельзя много употреблять в пищу продуктов содержащих щавелевую кислоту.
Предполагаемый ответ: щавелевая кислота, содержащаяся в листьях щавеля, ревеня, шпината, клевера и даже плодах томата. Но с данной кислотой нужно держать “ухо в остро”. Ее соли – оксалаты – нерастворимы в воде, поэтому “любители щавеля” могут заработать себе камни в почках и мочевом пузыре.
4 группа. Постановка эксперимента с лекарством “Ацидин-пепсин”Реактивы и оборудование: раствор лекарства “Ацидин-пепсин”, магний, нитрат серебра, карбонат натрия, пробирки, универсальная индикаторная бумага.
Задание. Доказать, что в состав лекарства “Ацидин-пепсин” входит соляная кислота.
Ход работы
- В пробирку налить 1 мл лекарства и смочить им универсальную индикаторную бумажку. Отметьте значение рН.
- В пробирку насыпьте немного магния и добавьте 2 мл лекарства. Что наблюдаете? Сделайте вывод. Составьте уравнение реакции.
- В пробирку налейте 2 мл карбоната натрия и добавьте 1 мл лекарства. Что наблюдаете? Сделайте вывод. Составьте уравнение реакции.
- В пробирку налейте 1 мл лекарства и добавьте 1 мл нитрата серебра. Что наблюдаете? Сделайте вывод. Составьте уравнение реакции.
- Результаты исследования запишите в отчет.
Вопрос: Объясните название “Ацидин-пепсин”. Для чего используют данное лекарство?
Предполагаемый ответ: Ацидин – кислота, пепсин – фермент. Пищеварительное ферментное средство. Пепсин и HCl (образуемая в результате гидролиза бетаина гидрохлорида) повышают кислотность желудочного сока, обладают протеолитическими свойствами, что способствует пищеварению в желудке.
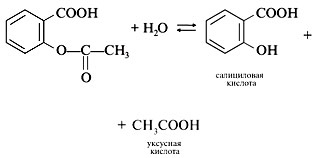
5 группа. Постановка эксперимента с ацетилсалициловой кислотойРеактивы и оборудование:. лекарство ацетилсалициловая кислота (аспирин), хлорид железа (III), соляная кислота, карбонат натрия, вода, пробирки, ступка с пестиком, ложечка для сыпучих веществ, держатель для пробирок, спиртовка, спички.
Задание Обнаружение функциональных групп в молекуле ацетилсалициловой кислоты
Ход работы
- Разотрите 2 таблетки аспирина в ступке.
- В пробирку поместите 2-3 крупинки ацетилсалициловой кислоты, добавляют 1 мл воды и энергично встряхивают. К полученному раствору прибавляют 1-2 капли раствора хлорида железа (III). Что наблюдаете? Сделайте выводы.
- В пробирку поместите измельченную таблетку ацетилсалициловой кислоты и добавьте 1 мл воды. Довести содержимое пробирки до кипения. Затем к полученному раствору прибавить 1-2 капли раствора хлорида железа (III). Что наблюдаете? Сделайте выводы. (Соблюдайте правила по ТБ)
- Разотрите таблетку аспирина, поместите порошок в пробирку, добавьте карбонат натрия и прокипятите с разбавленным раствором соляной кислоты и смесь нагрейте. Что наблюдаете? (Понюхайте)
- Результаты исследования запишите в отчет.
Вопрос: Какие функциональные группы входят в состав аспирина?
Предполагаемый ответ: В состав аспирина входит карбоксильная группа, которую можно доказать по наличию запаха уксусной кислоты. Появляется фиолетовое окрашивание, что указывает на выделение салициловой кислоты, содержащей свободную фенольную группу. Как сложный эфир ацетилсалициловая кислота легко гидролизуется при кипячении с водой.
Реактивы и оборудование:. уксусная кислота, этиловый спирт, серная кислота, пробирка, держатель для пробирок, спиртовка, спички, стаканы.
Задание. Получить сложный эфир.
Ход работы
- В пробирку налейте 2 мл этилового спирта, 2 мл уксусной кислоты и 1 мл концентрированной серной кислоты.
- Смесь хорошо перемешать и нагреть несколько минут на водяной бане (в стакане с горячей водой). Соблюдайте правила по ТБ.
- Понюхайте полученный раствор. Что наблюдаете? Сделайте вывод. Составьте уравнение реакции.
- Результаты исследования запишите в отчет.
Вопрос: Значение ароматерапии.
Предполагаемый ответ: Науку о лечении запахами называют ароматерапией. замечено, что запахи мирта, лимона, мяты оказывают тонизирующее действие на нервную систему, ароматы розы, жасмина, лаванды – успокаивающее. Запахи пиридина и толуола повышают остроту ночного зрения, а запахи бензола и гераниола – остроту слуха.
Зарядка для глаз. (Cлайд №7)
Защита проектов по группам. (Cлайд №8-16)
Общий вывод. (Cлайд №17)
1. Мы выяснили, где находятся и как применяются кислоты.
Применение кислот в жизни человека:
а – для дезинфекции сантехники, очистки плит,
при пайке металлов;
б – для получения лекарств, удобрений,
красителей, взрывчатых веществ;
в – в кулинарии.
2. Рассмотрели химические свойства кислот, на примере веществ окружающих нас в быту.
III. Закрепление.
Тест (Один человек у доски, остальные на своих местах. Приложение 5). (Слайд №18)
Ответы:
1 вариант: 1в, 2в, 3г, 4б, 5в, 6г, 7в.
2 вариант: 1в, 2в, 3б, 4г, 5г, 6б, 7г.
IV. Рефлексия. (Слайд №19)
Выберите себе понравившееся начало предложения и завершите его
- Сегодня узнал(а), что могу _______________________________
- Я считаю полезным _____________________________________
- Мне понравилось _______________________________________
- Мне было трудно ________________________________________
- Теперь бы я хотел(а) еще узнать____________________________
V. Домашнее задание. (Слайд №20)
Создать компьютерную презентацию по окружающим нас кислотам.