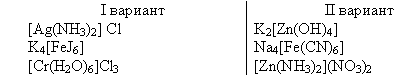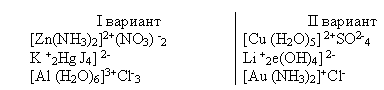Модуль для учителя.
Комплексные соединения (КС).
| УЭ1 – | Интегрирующая цель: 1. Познакомиться с
теорией строения комплексных соединений, номенклатурой комплексных
соединений; рассмотреть классификацию комплексных соединений по
различным признакам. Условия работы: 1) стремление к цели; Формы работы: коллективная, парная, индивидуальная. |
УЭ1 – Входной контроль: проверка знаний о классификации неорганических соединений.
Цель: проверить знания учащихся о номенклатуре и классификации неорганических соединениях.
ЗАДАНИЕ 1 (для всех).
1. Вспомнить классы неорганических соединений, которые изучались ранее. Расшифровать предложенную схему.
2. Какие вещества называют оксидами? Расскажите о классификации оксидов.
Приведите примеры.
3. Что объединяет кислоты и щелочи?
4. Какие вещества называют солями? Как классифицируют соли?
ЗАДАНИЕ 2 (по вариантам).
| I вариант | II вариант |
| 1. Какое соединение не является оксидом? | |
| а) К2О б) Mn2O7 в) H2O2 | а) OF2 б) NO2 в) Na2O |
|
2.Исключите “лишнее” вещество |
|
| а) K2CO3 б) Al(OH)3 в) MgOHCl | а) NaOH б) Ba(OH)2 в) FeOHCl |
|
3. Укажите вещество, пропущенное в цепочке превращения |
|
| Cu → X → CuCl2 а) CuO б) Cu(OH)2 в) CuCO3 |
Fe → X → Fe(OH)2 а) FeO б) FeS2 в) FeCl2 |
|
4.Какое утверждение по классифицированной характеристике неверно для |
|
| серной кислоты | фосфорной кислоты |
| а) кислородосодержащая б) сильная в) трехосновная г) растворимая | |
6 ВРЕМЯ РАБОТЫ с классом – 3 мин.
Выполнение теста – 2 мин.
Самоконтроль (правильные ответы на слайде).
Критерии оценок: “5” – нет ошибок; “4” – одна ошибка.
УЭ2 – Теория строения комплексных соединений
Цель: познакомиться с теорией комплексных соединений; уметь определить внешнюю и внутреннюю сферы КС, заряд комплексообразователя, координационное число (КЧ), заряд центрального атома (иона).
1. Рассказ учителя.
Теория комплексных соединений является созданная в 1893 году координационная теория швейцарского ученого Альфреда Вернера. Вернер предположил, что молекулы веществ с ковалентной полярной связью определенным образом располагаются вокруг
атома металла и прочно с ним связаны. Эти частицы образуют внутреннюю сферу комплексного соединения, которую называют комплексным ионом. Ионы неметалла связаны с металлом менее прочно и образуют внешнюю сферу комплексного соединения. Формулу вещества записывают так, чтобы выделить в квадратные скобки комплексный ион, например, [Ni (NH3)6] CI3. Каждый комплексный ион состоит из центрального иона металла (иона комплексообразователя) и лиганд (молекул или ионов). Количество лиганд внутри комплексного иона называют координационным числом (к. с.). координационное число может быть разным и изменяться от 1 до 12–14, но чаще это небольшое четное число – 2,4, 6, 8. Значение координационного числа зависит от радиуса атома центрального иона, его заряда и заряда лигандов. Чем больше радиус центрального иона, его заряд и противоположный заряд лигандов, тем должно быть больше координационное число иона комплексообразователя. Образование внутренней сферы комплексного соединения происходит за счет донорно – акцепторной связи, где например, молекулы аммиака являются донорами, а ионы никеля – акцепторами электронных пар.
Схема строения комплексного соединения:
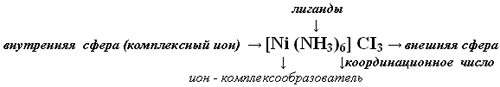
Связь между внешней и внутренней сферами комплексного соединения имеет ионный характер и легко разрушается в воде с образованием ионов:
Уравнение диссоциации КС: [Ni (NH3)6] CI3 → [Ni (NH3)6]+3 + 3CI-.
Комплексные соединения – это вещества, в молекулу которых входит комплексный ион, образованный ионом металла и лигандами.
Определение заряда комплекса и комплексообразователя:
Na+ [Al +х (OH)4– ]-
+1 + х + (– 1) ∙ 4 = 0
Х = +3
На слайде – определения:
Комплексный ион – ион, состоящий из d – металла и лигандов.
Лиганд – молекула или ион, входящий в состав комплексного иона, с связанный с d – донорно – акцепторной связью.
Координационное число – количество лиганд, входящих в состав комплексного иона.
Вакансия – свободная электронная ячейка d – металла, которая может быть использована для образования донорно – акцепторной связи с лигандами.
Комплексное соединение – сложное вещество, в состав которого входит комплексный ион.
2. Задание для учащихся – определить внешнюю и внутреннюю сферу комплексных соединений, заряд центрального иона металла, заряд комплексного иона для соединений:
| Н4[PtCl6] | [Cu(NH3)2]SO4 |
| К FeF6] | [Сr (H2O)6] CI3 |
УЭ3 – Номенклатура и классификация комплексных соединений
Цель: познакомить учащихся с классификацией и номенклатурой КС.
I. Изучение правил номенклатуры КС, рассмотрение приведенных ниже примеров .
1. Название комплексов строится по схеме: (справа налево по формуле)
ЧИСЛО ЛИГАНД → НАЗВАНИЯ ЛИГАНД → НАЗВАНИЕ ЦЕНТРАЛЬНОГО АТОМА
2. Названия аниона (в именительном падеже), затем – катион (в родительном падеже), независимо от того, какой из этих ионов комплексный.
3. Название комплексного соединения строится из:
– греческого числительного, указывающего число лиганд
– название лиганда;
– название центрального атома или иона (если это комплексный катион, то название
(в родительном падеже) не меняется, если это комплексный анион, то
прибавляется суффикс “-ат”);
– числа, указывающие валентность комплексообразователя, записываются римской
цифрой в круглых скобках.
| ПРИМЕР | НАЗВАНИЕ |
| Cu(NH3)4](OH)2 Na[Al(OH)4] |
гидроксид тетраамминомеди (II) тетрагидроксоалюминат натрия |
ЗАДАНИЕ учащимся:
Дайте название следующим КС
| I вариант | II вариант |
| [Ag(NH3)2] Cl K4[FeJ6] [Cr(H2O)6]Cl3 |
K2[Zn(OH)4] Na4[Fe(CN)6] [Zn(NH3)2](NO3)2 |
II. Знакомство с классификацией комплексных соединений
| ПРИЗНАК КЛАССИФИКАЦИИ | ГРУППЫ КС | ПРИМЕРЫ |
| 1. По внутренней сфере | а) катионные комплексы б) анионные комплексы в) нейтральные комплексы |
[Au(NH3)2]+Cl- K4[Fe(CN)6]4- [CO(H2O)3Cl3] |
| 2. По природе лиганд | а) ацидокомплексы (лиганды – кислотные остатки) б) аквакомплексы (лиганды – молекулы воды) в) аммиакаты (лиганды – молекулы аммиака) г) гидроксокомплексы (лиганды – гидроксид-ионы) |
K3[Fe(CN)6] [Al(H2O)6]Cl3 [Zn(NH3)4]SO4 K[Al(OH)4] |
| 3. По способности проводить электрический ток | а) электролиты б) неэлектролиты |
[Cu(NH3)4](OH)2 [Ni(CO)4] |
ЗАДАНИЕ учащимся: дать характеристику КС, используя различные признаки классификации.
| I вариант [Zn(NH3)2]2+(NO3) K [Hg J4] 2- [Al (H2O)6]3+Cl |
II вариант [Cu (H2O)5] 2+SO Li [Be(OH)4] 2- [Au (NH3)2]+Cl- |
При выполнении индивидуальной работы учащиеся обращают внимание на время, отведенное для работы; проверку заданий для самостоятельной работы сравнивают с правильными ответами на слайде.
УЭ4 – Способы получения комплексных соединений.
Просто знать – еще не все, знания нужно уметь использовать
Гете
Цель: исследовать вопрос, каким образом можно получить комплексные соединения.
ИНСТРУКТАЖ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ.
Оборудование и реактивы: хлорид железа (III), желтая кровяная соль K4[Fe(CN)6], сульфат железа (II), красная кровяная соль K3[Fe(CN)6], штатив для пробирок, пробирки.
ОПЫТ 1. Качественная реакция на ион Fe 3+
В пробирку с раствором желтой кровяной соли (пробирка № 1) прилить по каплям раствор хлорида железа (III). Что наблюдаете?
Записать уравнение по схеме:
хлорид железа (III) + желтая кровяная соль → гексацианоферрат (II) железа (III) +хлорид калия
ОПЫТ 2. Качественная реакция на ион Fe 2+
К раствору красной кровяной соли (пробирка № 2) добавить раствор сульфата железа (II). Что произошло?
Записать уравнение по схеме:
сульфат железа(II) + красная кровяная соль →сульфат калия + гексацианоферрат (III) железа (II)
Уборка рабочего места: аккуратно поставьте лоток со стаканами, штатив с пробирками около лотка, проверьте все ли реактивы стоят на месте.
Контроль: проверь запись уравнений (слайд).
Критерии оценок:“5” – нет ошибок; “4” – одна ошибка.
УЭ5 – Выходной контроль: проверка усвоения знаний о комплексных соединениях
Цель: проверить усвоение знаний учащихся, полученных на уроке о комплексных соединениях.
ЗАДАНИЕ 1 (для всех).
Составить формулу комплексного соединения, если известно, что его молекула содержит ионы Ni2+, 3Cl-, а также три молекулы NH3. Известно, что при взаимодействии 0,1 моля этого вещества с избытком нитрата серебра получается 0,2 моля хлорида серебра, другие частицы не обнаруживаются.
ЗАДАНИЕ 2 (для всех).
Написать уравнения диссоциации следующих веществ:
| K2[Zn(OH)4]
[Zn(NH3)2](NO3)2 |
Na4[Fe(CN)6] [Cu(H2O)5]SO4 |
ЗАДАНИЕ 3 (для всех).
Определите массовую долю центрального атома (иона) в следующих соединениях:
| K2[HgJ4] | Na[Al(OH)4] |
ЗАДАНИЕ 4 (для всех).
Закончить уравнения химических реакций:
| а) NaOH + Be(OH)2→ | б) Ag2O + NH3 ∙ H2O→ | в) C6H5NH2 + HCl→ |
ЗАДАНИЕ 5 (для всех).
Вычислите объем газа (н.у.), который выделится при взаимодействии алюминия массой 2,7г. с 40%-ным раствором гидроксида калия массой 50г.
Предложенные задания отличаются степенью сложности, поэтому вам предоставляется возможность выбрать задания с учетом своих индивидуальных особенностей.
Контроль осуществляет учитель.
УЭ6 – Резюме.
- 23–25Б – оценка “5”;
- 18–22Б – оценка “4”;
- 15–17 – оценка “3.
Учащиеся в конце урока ведут подсчет заработанных баллов, результат которых позволят учителю оценить учебное занятие.
УЭ7 – Рефлексия.
– Я узнал (а) много нового на уроке?
– В чем польза этого урока для тебя?
– Твоя оценка тебе и соседу?
а) J б)K в)L СПАСИБО ЗА РАБОТУ НА УРОКЕ!
Учащиеся ставят знаки “+” или “–” около каждого утверждения. После окончания работы ребята кратко комментируют свои результаты, объясняя, какое утверждение для них является наиболее значимым. Используя результаты, педагог с учетом подготовленности учащихся определит, какая информация по данной теме и в каком объеме он предложит на уроках, а какой включит в самостоятельную работу или вынесет на занятие элективного курса.
Модуль для ученика.
Комплексные соединения (КС)
УЭ – Учебный элемент.
УЭ0 – Интегрирующая цель.
УЭ1 – Входной контроль: проверка знаний о классификации
неорганических соединений.
УЭ2 – Теория строения комплексных соединений.
УЭ3 – Номенклатура и классификация комплексных соединений.
УЭ4 – Способы получения комплексных соединений.
УЭ5 – Выходной контроль: проверка усвоения знаний о
комплексных соединениях.
УЭ6 – Резюме.
УЭ7 – Рефлексия.
| УЭ | Учебный материал с указанием заданий | Указания к выполнению работы | ||||
| УЭ0 | Интегрирующая цель:
Условия работы:
|
На доске: “Комплексные соединения” На столе учащихся: растворы FeCl3(III), K4[Fe(CN)6] (желтая кровяная соль), FeSO4 (II), K3[Fe(CN)6] (красная кровяная соль), пробирки. |
||||
| УЭ1 | Цель: проверить усвоение знаний о номенклатуре и
классификации неорганических соединений. ЗАДАНИЕ 1 (для всех) 1. Вспомните неорганические соединения каких классов мы изучали. Расшифруйте схему:
2. Какие вещества называют оксидами? Расскажите о классификации оксидов. Приведите примеры. 3. Что объединяет кислоты и щелочи? 4. Какие вещества называют солями? Как классифицируют соли? ЗАДАНИЕ 2 (по вариантам)
|
ФРОНТАЛЬНАЯ РАБОТА 6 ВРЕМЯ РАБОТЫ 3 мин.
Выполнение теста 6 Время работы 2 мин. Самоконтроль: Правильные ответы на слайде Критерии оценок: |
||||
| УЭ2 | Цель: познакомиться с теорией комплексных
соединений; уметь определить внешнюю и внутреннюю сферы КС, заряд
комплексообразователя, координационное число (КЧ), заряд центрального
атома (иона).
H4[PtCI6] [Cu(NH3)2]SO4 K4[FeF6] [Cr(H2O)6]CI3 |
6 Время работы 10 мин. Рассказ учителя (презентация). Составление краткого конспекта в рабочей тетради. Работа в ППС с последующей проверкой КОНТРОЛЬ: |
||||
| УЭ3 | Цель: познакомиться с классификацией и
номенклатурой КС. I. Внимательно изучи правила номенклатуры КС, рассмотри приведенные ниже примеры. 1. Название комплексов строится по схеме: (справа налево по формуле) ЧИСЛО ЛИГАНД → НАЗВАНИЯ ЛИГАНД → НАЗВАНИЕ ЦЕНТРАЛЬНОГО АТОМА 2. Названия аниона (в именительном падеже), затем – катион (в родительном падеже), независимо от того, какой из этих ионов комплексный. 3. Название комплексного иона строится из:
ЗАДАНИЕ: Дайте название следующим КС.
Познакомься с классификацией КС.
ЗАДАНИЕ: Дайте характеристику КС, используя различные признаки классификации.
|
6 Время работы 4мин. Работа в ППС
? ПОМНИ НАЗВАНИЕ ЛИГАНД: Н2О – аква- .Индивидуальная работа 6 Время работы 3 мин. Правильные ответы на слайде
6 Время работы с таблицей 4 мин. Работа в ППС
Критерии оценок:
|
||||
| УЭ4 |
Цель: исследовать вопрос, каким образом можно получить комплексные соединения ИНСТРУКТАЖ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ. Оборудование и реактивы: хлорид железа (III), желтая кровяная соль K4[Fe(CN)6], сульфат железа (II), красная кровяная соль K3[Fe(CN)6], штатив для пробирок, пробирки. ОПЫТ 1. Качественная реакция на ион Fe 3+ В пробирку с раствором желтой кровяной соли (пробирка № 1) прилить по
каплям раствор хлорида железа (III). Что наблюдаете? Напишите уравнение
по схеме: ОПЫТ 2. Качественная реакция на ион Fe 2+ К раствору красной кровяной соли (пробирка № 2) добавить раствор сульфата железа (II). Что произошло? Напишите уравнение по схеме: |
6 Время работы 7 мин. Работа в парах Уборка рабочего места: аккуратно поставьте штатов с пробирками около лотка с реактивами; проверьте все ли реактивы стоят на своем месте. Контроль: проверь запись уравнений (слайд) Критерии оценок: |
||||
| УЭ5 | Цель: проверить усвоение знаний учащихся,
полученных на уроке о комплексных соединениях. ЗАДАНИЕ 1 (для всех). Составить формулу комплексного соединения, если известно, что его молекула содержит ионы Ni2+, 3Cl-, а также три молекулы NH3. Известно, что при взаимодействии 0,1 моля этого вещества с избытком нитрата серебра получается 0,2 моля хлорида серебра, другие частицы не обнаруживаются. ЗАДАНИЕ 2 (для всех). Написать уравнения диссоциации следующих веществ: K2[Zn(OH)4] ЗАДАНИЕ 3 (для всех). Определите массовую долю центрального атома (иона) в следующих соединениях: К2[HgI4] Na[AI(OH)4] ЗАДАНИЕ 4 (для всех). Закончить уравнения химических реакций: а) NaOH + Be (OH)2 → ЗАДАНИЕ 5 (для всех). Вычислите объем газа (н.у.), который выделится при взаимодействии алюминия массой 2,7 г. с 40 % – ным раствором гидроксида калия массой 50 г. |
Предложенные задания отличаются степенью сложности, поэтому вам предоставляется возможность выбрать задания с учетом своих индивидуальных особенностей.
Контроль осуществляет учитель |
||||
| УЭ6 | РЕЗЮМЕ. Если Вы набрали:
|
СПАСИБО ЗА УРОК! Оценка ставится в рабочей тетради |
||||
| УЭ7 | – Я узнал (а) много нового на уроке? – В чем польза этого урока для тебя? – Твоя оценка тебе и соседу? а) J б)K в)L |
Учащиеся ставят знаки “+” или
“–” около каждого утверждения. |