Цель урока: сформировать у учащихся понятие бинарных соединений на примере оксидов.
Задачи урока:
- Образовательные: дать знания учащимся об оксидах, научить выделять оксиды среди других веществ, составлять формулы оксидов на основе знаний о степени окисления, раскрыть связь между химическими знаниями и повседневной жизнью человека, расширить представления учащихся о важнейших оксидах, их свойствах и роли в природе и жизни человека.
- Воспитательные: воспитывать культуру речи, поведения, чувство ответственности за сохранение оксидов.
- Развивающие: развивать познавательный интерес к предмету, такие процессы как внимание, логическое мышление, интерес к предмету, навыки самостоятельной работы с учебником, умение анализировать информацию, применять теоретические знания на практике; продолжить развитие химической речи учащихся, таких понятий как бинарные соединения, степень окисления; расширить кругозор учащихся с привлечением дополнительных источников информации.
Тип урока: урок изучения нового материала
Оборудование: коллекция горных пород: кварц, яшма, красный железняк, бурый железняк, магнитный железняк; дидактический материал (схемы: "Общая формула", "Название оксидов"), карточки-задания; компьютер, телевизор,
На ученических столах: коллекция "Известняки".
На классной доске: общая формула оксидов, формулы веществ, блоковая схема "Названия оксидов".
Структура урока
I. Организационный момент
II. Изучение нового материала
III. Закрепление
IV. Заключение
V. Домашнее задание
Ход урока
I. Организационный момент (1 мин)
Приветствие учителя. Проверка готовности класса к уроку. Психологический настрой класса. Отмечание отсутствующих.
II. Изучение нового материала (35 мин)
1. Подведение к теме урока.
Вступительное слово учителя с элементами беседы.
Добрый день ребята и уважаемые гости!
Мы продолжаем изучение соединений химических элементов. На предыдущих уроках мы познакомились с бинарными соединениями. Скажите, какие соединения называются бинарными? (соединения, которые состоят из двух элементов)
Среди представленных формул, определите формулы бинарных соединений: Fe, СН4, CuSO4, CO2, H2O, KOH, Fe2O3, SO2, HNO3. (CO2, СН4, H2O, Fe2O3, SO2) .
Формулы каких соединений не являются бинарными? (учитель снимает лишние формулы с доски).
Среди оставшихся формул найдите лишнюю формулу. Ответ объясните (СН4, так как в состав не входит кислород).
Что общего в оставшихся формулах?
1) Сложные вещества
2) Состоят из 2-х элементов
3) Одним из элементов является кислород (вывешивание терминов на доске)
Данные бинарные соединения относятся к классу веществ, называемых оксидами.
Тема нашего урока: "Оксиды. Важнейшие оксиды в природе и жизни человека". (Запись даты и темы урока в тетради (Слайд 1).
Цель данного урока - узнать как можно больше об оксидах, их важности в нашей жизни, научиться различать среди других веществ.
Сегодня мы посмотрим на оксиды глазами химика, биолога, медика, геолога, эколога. Мы обратимся к нашей периодической рубрике фотозагадок. Вы приятно удивитесь, оказывается, мы уже встречались с данными веществами, но не думали о том, что это оксиды. А ещё вы удивитесь поощрению вашей работы в конце урока.
2. Оксиды.
Беседа с элементами объяснения, выполнение упражнения на доске и в тетради.
Попробуйте дать определение оксидам, опираясь на ключевые слова на доске. (Оксиды - сложные вещества, состоящие из двух элементов, одним из которых является кислород.)
Сравним ваше определение с определением в учебнике (параграф 18 стр. 91) (Оксиды - сложные химические вещества, состоящие из двух химических элементов, один из которых в степени окисления: -2). Чем отличается ваше определение оксидов от определения в учебнике? (в определении учебника указана степень окисления кислорода). Это важная деталь для оксидов.
Теперь составим общую формулу для всех оксидов (на доске и в тетради):
![]()
Вернёмся к формулам оксидов.
Задание №1. (ученик у доски)
Определите степени окисления каждого элемента в формулах соединений:
![]()
Молодцы! С заданием справились. Можно идти дальше.
3.Названия оксидов.
Объяснение учителя с элементами беседы. Выполнение упражнения на доске и в тетради.
Сейчас мы научимся давать названия оксидам. Названия оксидам можно дать несколькими способами (вывешивание схемы на доске, запись в тетради).
Первый способ: любой оксид называют оксидом с указанием названия элемента в родительном падеже. При этом если элемент имеет несколько степеней окисления, то это отражают в названии, ставя в скобках соответствующую римскую цифру.
Блоковая схема на доске
Название оксида ="оксид" + название элемента в родительном падеже + (степень окисления)
Какие элементы могут иметь несколько степеней окисления? (неметаллы, металлы побочных подгрупп)
Например:
SO2 - оксид серы (IV)
Второй способ: названия оксидов зависят от числа атомов кислорода в формуле, которое указывается с помощью греческих числительных. Карточки с названиями греческих числительных вы можете увидеть у себя на столе.
Например:
SO2 - диоксид серы
Существуют и тривиальные названия оксидов.
Например:
SO2 - сернистый газ
Что вы слышали об этом оксиде? (приводит к образованию кислотных дождей)
Задание №2. (2 ученик у доски)
Дать названия оставшимся оксидам.
CO2 -оксид углерода (IV)
диоксид углерода
углекислый газ
H2O - оксид водорода (I)
монооксид водорода
вода
Fe2O3- оксид железа (III)
монооксид железа
красный железняк (Данный оксид находится у вас на столах)
Итак, мы научились давать названия оксидам. Переходим вопросу о физических свойствах оксидов.
4. Физические свойства оксидов
Беседа с элементами объяснения. Самостоятельная работа с учебником, дополнительными источниками информации.
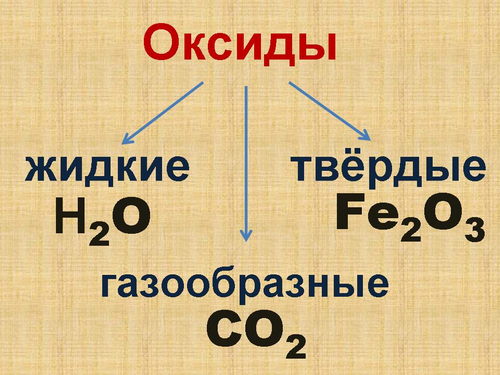
Физические свойства оксидов разнообразны. Среди них встречаются газы, жидкости и твёрдые вещества. (Составление схемы в тетради, Слайд 2)
Оксиды
- газообразные
- жидкие
- твёрдые
- Приведите пример газообразного оксида? (углекислый газ) К какой группе оксидов мы его отнесём? (газообразные)
- Каким оксидом образована водная оболочка Земли? (водой) К какой группе оксидов мы её отнесём? (жидкие)
Среди оксидов очень много твёрдых веществ. Некоторые из них представлены у нас в лаборатории, например, оксид меди (II), алюминия, свинца (II). Многие твёрдые оксиды встречаются в природе в виде горных пород. У вас на столах находятся образцы природных оксидов. Аккуратно пододвиньте ящик с горными породами к себе. Соблюдая правила охраны труда, не трогайте их руками.
-Какие горные породы вы видите? (кварц, яшма, красный железняк, бурый железняк, магнитный железняк)
- Какими оксидами они образованы? (кварц, яшма - диоксидом кремния, красный железняк - триоксидом железа, бурый железняк - триоксидом железа и несколькими молекулами воды, магнитный железняк - смесью триоксида железа диоксида железа)
Познакомимся поближе с представителями каждой группы оксидов.
Сейчас каждый ряд получает формулу своего оксида.
1 ряд 2 ряд 3 ряд H2O CO2 Fe2O3
Ваша задача - составить визитную карточку оксида, по плану (Слайд 3):
а) Формула
б) Название
в) Физические свойства (агрегатное состояние, цвет, растворимость в воде)
г) Нахождение в природе
д) Значение:
- для природы
- для человека
Для составления визитной карточки оксида используйте информацию, расположенную у вас на столах (Приложение 1). Проверка (Слайд 4-7).
Какой из этих оксидов является самым главным важным для нас в окружающем мире? (Вода)
Познакомимся с другими представителями оксидов.
Рубрика фотозагадок (Слайд 8 - 16):
Этот оксид стал важной причиной всемирного потепления климата, используется растениями в процессе фотосинтеза (углекислый газ).
Этот газ очень коварен, так как совершенно не имеет запаха. Образуется везде, где есть горение, даже в духовке при недостатке кислорода. О его присутствии нельзя узнать, пока не почувствуешь недомогание, а для отравления достаточно небольшого его количества (угарный газ).
Что общего в этих картинках? ("Лисий хвост" - жаргонное название выбросов в атмосферу бурого оксида азота на химических предприятиях (иногда - из выхлопных труб "плохих" автомобилей).
Один из самых распространённых минералов в земной коре? (Кварц - природный кремнезём диоксид кремния SiO2. Широко применяется в силикатной промышленности при производстве стекла, керамики). Его разновидностями являются горный хрусталь, агат, аметист, халцедон, которые используются для изготовления ювелирных изделий и предметов роскоши, а также различной магической атрибутики.
Для изготовления титановых белил используется TiO2 - оксид титана (IV) (диоксид титана).
Оксид цинка (ZnO) - для изготовления цинковых белил.
Оксимд камльция (негашёная имзвесть или "кипелка") - белое кристаллическое вещество, соединение CaO. Негашёная известь в качестве известкового цемента и продукт её взаимодействия с водой - Ca(OH)2 (гашёная известь или "пушонка") находят обширное использование в строительном деле. Однако в настоящее время известковый цемент при строительстве жилых домов стараются не применять, так как полученные строения обладают способностью впитывать и накапливать сырость. В пищевой промышленности зарегистрирован в качестве пищевой добавки E529.
Оксиды - очень распространённый в природе класс сложных веществ, имеющих значение для человека, как положительное так и отрицательное.
IV. Закрепление (4 мин)
Выполнение самостоятельной работы. Взаимопроверка.
Проверим, насколько хорошо вы усвоили тему оксиды. Возьмите лист с самостоятельной работой (Приложение 2). Вы видите перечень утверждений. Если утверждение верное на ваш взгляд, то вы ставите знак "плюс", неверное - знак "минус".
Вариант 1
1.Оксиды - это простые вещества.
2. H2SO4 - это оксид.
3. Степень окисления хлора в Cl2O7 равна +7.
4. ZnO - это оксид металла.
5. Диоксид меди имеет формулу Cu2O.
6. Формула оксида фосфора (V) - P2O5.
7. Оксид углерода (IV) поддерживает горение.
Вариант 2
1. Оксиды состоят из двух элементов.
2. LiOH - это не оксид.
3. Степень окисления фосфора в Р2О3 равна - 3.
4. SO3 - это оксид неметалла.
5. Монооксид магния имеет формулу MgO.
6. Формула оксида калия - К3О.
7. Оксид углерода (II) используют для приготовления сухого льда.
Обменяйтесь листочками. Проверим ваши ответы. Правильные ответы высвечиваются на слайде (Слайд 17,18).
V. Заключение (4 мин)
Заключительное слово учителя.
Мы живём на планете с кислородной атмосферой, поэтому наша жизнь, протекающая на Земле, связана с химией кислородсодержащих соединений. Оксиды - это большой класс кислородсодержащих веществ, но далеко не единственный.
Сегодня вы хорошо поработали.
Подводя итог урока, я хочу обратить ваше внимание на следующий факт. День, в который мы проводим урок является очень важным в истории человечества. 10 декабря - это день памяти Альфреда Нобеля (Слайд 19,20). В этот день король Швеции вручает нобелевские премии за выдающиеся достижения в разных областях наук. Каждый лауреат кроме премии получает и вот такую медаль. Возможно, кто-нибудь из вас в будущем станет учёным, чем-то заинтересуется и совершит какое-нибудь открытие, в том числе и связанным с оксидами. А почему бы и нет? Вспомните глобальное потепление климата, вызванное переизбытком углекислого газа в атмосфере. Я надеюсь, вы тогда вспомните этот день и мои слова. У вас будет возможность как у любого человека претендовать на эту премию. А сейчас я хочу поощрить этими скромными золотыми медалями самых активных на уроке.
V. Домашнее задание (1 мин)
Параграф 18 (учебник: Химия.8 класс. О.С.Габриелян.- М.: Дрофа.)
1) Составьте формулы оксидов по их названиям:
а) оксид серы (VI);
б) оксид натрия;
в) оксид меди (II);
г) оксид азота (II);
д) оксид фосфора (III);
е) оксид марганца (IV).
2) Расшифруйте фразу: "Дела как сажа бела". Каким оксидом образована белая сажа? Вычислите массовые доли каждого элемента в белой саже.