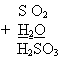Тип урока: усвоение новых знаний
Цели урока:
- сформировать понятия "кислоты", "индикаторы";
- познакомиться с общей формулой, классификацией, названиями кислот;
- продолжить формирование навыков составления формул оксидов, соответствующих гидроксидам (кислотам), и наоборот;
- повторить номенклатуру оксидов;
- закрепить решение задач на нахождение количества вещества, числа атомов элемента по известной массе вещества.
Общая формула кислот HmAc, где (Ас) - кислотный остаток
Кислоты - сложные вещества, состоящие из катионов водорода и аниона кислотного остатка.
Число атомов водорода в кислоте определяют по степени окисления кислотного остатка, и наоборот.
Классификация кислот:
а). по основности (по числу атомов водорода):
- одноосновные (HNO2; HCl)
- многоосновные (H2SO4)
б). по растворимости:
- не растворимые (H2SiO3)
- растворимые (все остальные)
в). по наличию атомов кислорода в кислотном остатке:
- бескислородные (H2S)
- кислородсодержащие (H2SO4)
г). по летучести:
- летучие (HNO3, H2SO3, HCl , H2CO3, H2S)
- нелетучие (все остальные)
д). по силе (степени диссоциации):
- сильные (H2SO4, HNO4, HCl, HClO4, HMnO4, H2CrO4, HBr, HI, HClO3)
- слабые (все остальные)
е). по стабильности:
- стабильные (HCl, H3PO4, H2SO4, HNO22)
- нестабильные (все остальные)
Задание № 1. Используя различные признаки классификации кислот, дайте характеристику фосфорной кислоты.
Задание № 2.
Заполните таблицу:
| Формула кислоты | Название кислоты | Кислотный остаток и его ст. ок. | Название кислотного остатка (соли) | Кислотный оксид | Название кислотного оксида |
| +1 -1 HCl |
хлороводородная (соляная) | -1 Cl |
хлорид | _ | _ |
| +1 +5 -2 H3PO4 |
ортофосфорная | -3 (PO4) |
ортофосфат | +5 -2 P2O5 |
оксид фосфора (V) |
| H2SO4 | серная | -2 (SO4) |
сульфат | ? | ? |
| H2SO3 | сернистая | - ? (SO3) |
сульфит | ? | ? |
| HNO3 | азотная | - ? (NO3) |
нитрат | ? | ? |
| HNO2 | азотистая | -? (NO2) |
нитрит | ? | ? |
| H2CO3 | угольная | -? (CO3) |
карбонат | ? | ? |
| H2SiO3 | кремниевая | -? (SiO3) |
силикат | ? | ? |
| H2S | сероводородная | -? S |
сульфид | - | - |
Номенклатура (названия) кислот:
с.о. = + № группы (суффикс -ная, -овая); с.о. = +(№ группы-4) (суффикс -истая)
с.о. = + (№ группы-2) (суффикс -оватая); с.о. = +(№ группы-6) (суффикс -оватистая)
Для распознавания кислот и оснований используют индикаторы.
Индикаторы- это вещества, которые изменяют свою окраску под действием кислот и оснований.
| Название индикатора | кислая среда | нейтральная среда | щелочная среда |
| лакмус | розовый | фиолетовый | синий |
| фенолфталеин | бесцветный | бесцветный | малиновый |
| метилоранж | розовый | оранжевый | жёлтый |
Задание № 3. Задача.
Какое количество вещества составляют 490 мг. фосфорной кислоты? Сколько атомов водорода будет содержаться в этой порции кислоты?
Задание№ 4. Задача.
Составить формулы кислот, соответствующие оксидам: SO3, N2O5, CO2, P2O5.
Пример:
- Какие вещества называют кислотами?
- Как определить основность кислоты?
- Как распознать кислоту среди выданных веществ?
Домашнее задание.