Цель урока: учащиеся должны провести анализ общих свойств минеральных кислот, и на его основе изучить свойства разбавленной и концентрированной серной кислоты, отметить черты сходства и отличия в физических и химических свойствах.
Метод урока: словесно-наглядный.
Межпредметные связи: биология (воздействие кислот на органические вещества).
Оборудование: штатив с пробирками, индикатор (лакмус, метиловый оранжевый, универсальная индикаторная бумага), держатель для пробирок, стеклянная палочка, спички, спиртовка, фильтровальная бумага, химический стакан.
Реактивы: H2SO4 (конц.), H2SO4 (разб.), Cu, Zn, CuO, NaOH, BaCl2, СuCl2, С, S, H2O, сахароза.
Содержание урока
I. Организационный момент (1–2 мин.)
II. Изучение нового материала (30 мин.)
Учитель: сегодня мы познакомимся с одним из кислородных соединений серы – серной кислотой.
Учитель: составим кластер “Серная кислота”. (Происходит актуализация и систематизация ранее полученных знаний.)
Учитель при составлении кластера может направлять мыслительную деятельность учащихся с помощью следующих вопросов:
– Что вы знаете о серной кислоте?
– Какими физическими свойствами обладает это вещество?
– Какими химическими свойствами может обладать серная кислота, как минеральная кислота?
– Известны ли вам какие-то специфические свойства серной кислоты?
– В каких областях промышленности применяется это вещество?
(Все предположения учащихся, как верные, так и неверные, записываются на доске учителем и составляется кластер схема 1).
Кластер “Серная кислота”
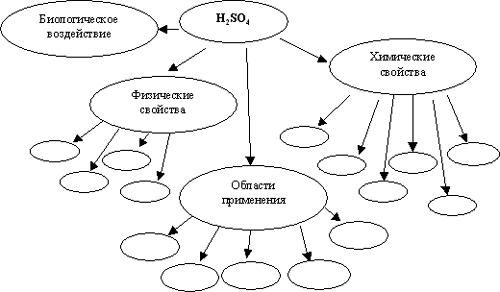
Схема 1
Записав все предположения учащихся в виде кластера (схема 1), учитель переходит к объяснению нового материала. Схема составленного кластера сохраняется до конца урока.
1) Физические свойства.
Учитель: Какими физическими свойствами обладает серная кислота? Ответим на этот вопрос с помощью эксперимента.
Опыт 1: Демонстрация агрегатного состояния концентрированной серной кислоты, растворение в воде (обращается внимание на технику безопасности: в частности на то, что нельзя приливать воду к кислоте, нужно осторожно вливать кислоту в воду, помешивая раствор).
Учитель: охарактеризуйте физические свойства серной кислоты.
Вывод: Серная кислота – бесцветная маслянистая тяжелая жидкость, хорошо растворимая в воде и имеет плотность равную 1,86 г/мл
2) Химические свойства.
Учитель: Какими химическими свойствами обладает это вещество? Одинаковы ли свойства у концентрированной и разбавленной серных кислот? Определим это с помощью эксперимента и выводы внесем в таблицу 1.
Учитель: Сравним свойства концентрированной и разбавленной серной кислот. Разделите тетрадный лист на три графы. Первая графа – “свойства”, вторая – “свойства разбавленной серной кислоты”, а третья – “свойства концентрированной серной кислоты”. (Изучение свойств разбавленной и концентрированной серной кислоты проводится с помощью демонстрационного эксперимента, на основе которого заполняется таблица 1).
“Свойства разбавленной и концентрированной серных кислот”. Таблица 1.
| Свойства | H2SO4 разб. | H2SO4 конц. |
| Индикатор: а) лакмус б) метиловый оранжевый |
Опыт 1: Действие кислот на индикаторы | |
| Красный Розовый |
Не изменяет окраску индикаторов | |
| Диссоциация кислоты в воде | H2SO4 = H+ + HSO4- HSO4– = H+ + SO42- |
НЕ ДИССОЦИИРУЕТ |
| С металлами, стоящими в электрохимическом ряду напряжений до водорода | Опыт 2: Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода | |
| H2+SO4 + Zn0
= Zn+2SO4 +H20↑ H+ – окислитель Zn0 – восстановитель |
4H2S+6O4 + 3Zn0
= 3Zn+2SO4 + S0↓ + 4H2O S+6 – окислитель Zn0 – восстановитель 5H2SO4 + 4Ca = 4CaSO4 + H2S↑ + 4H2O На холоде пассивирует за счет образования пленки оксидов их соли с Fe, Cr, Ni, Bi, Co, Mg, Al |
|
| С металлами, стоящими в электрохимическом ряду напряжений после водорода | Опыт 3: Взаимодействие металлами, стоящими в электрохимическом ряду напряжений после водорода | |
| НЕ РЕАГИРУЕТ | 2H2S+6O4 + Cu0
= Cu+2SO4 + S+4O2
+ 2H2O S+6 – окислитель Cu0 – восстановитель Не реагирует с Au и Pt |
|
| С основными оксидами | Опыт 4: Взаимодействие с основными
оксидами H2SO4 + CuO = CuSO4
+ H2O |
|
| С основаниями | Опыт 5: Взаимодействие с щелочами
(реакция нейтрализации) H2SO4 +
2NaOH = Na2SO4 + 2H2O Взаимодействие с нерастворимыми основаниями H2SO4 + Cu(OH)2↓ =
CuSO4 + 2H2O |
|
| Качественная реакция на SO42- | Опыт 6: Доказательство наличия
сульфат-иона H2SO4 + BaCl2
= BaSO4↓ + 2HCl |
|
| С неметаллами | Опыт 7: Взаимодействие с неметаллами | |
| НЕ РЕАГИРУЕТ | 2H2S+6O4 + C0
= 2S+4O2↑ + CO2↑ + +2H2O S+6 – окислитель C0 – восстановитель 2H2S+6O4 + S0 = 3S+4O2 + 2H2O S+6 – окислитель S0 – восстановитель |
|
| Органические вещества | Опыт 8: Взаимодействие с органическими веществами | |
| НЕ РЕАГИРУЕТ | обугливание древесины, клетчатки, сахарозы | |
III. Закрепление нового материала (5 мин.)
Учитель: исходя из знаний, полученных на этом уроке, я предлагаю вам, вновь обратиться к кластеру, составленному в начале урока
Учащиеся сопоставляют, что они знали, и что узнали нового о серной кислоте.
В заключительной части урока происходит закрепление изученного материала и рефлексия с помощью кластера, который был составлен в начале урока. Учитель просит учащихся проверить правильность, высказанных ранее предположений по свойствам серной кислоты. Ученики исправляют ошибки в своих высказываниях и дополняют схему 1 новыми сведениями, полученными в процессе изучения нового материала. Возможный вариант дополненного и исправленного кластера представлен на схеме 2.
Кластер “Серная кислота”
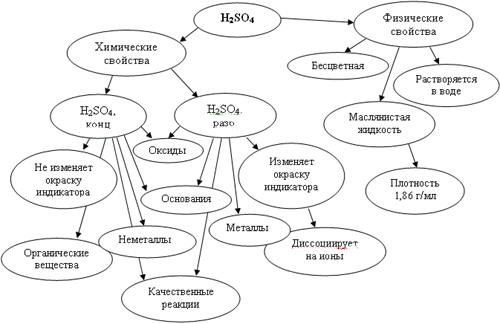
Схема 2
IV. Выставление отметок с комментариями (1–2 мин.)
V. Домашнее задание (1–2 мин.)
Такой подход к ведению урока позволяет: во-первых, изучить свойства концентрированной и разбавленной серных кислот в сравнении, и, во-вторых, активизировать учебную деятельность учащихся. Применение кластера помогает активизировать внимание учащихся, их учебную деятельность, что в целом способствует более эффективному усвоению изучаемого материала. При этом ученики учатся видеть ошибки, самостоятельно их исправлять, рассуждать, обобщать полученные знания, отвергать или наоборот принимать мнение других. В процессе такого урока учащиеся не присваивают готовые знания, а самостоятельно ищут ответы на поставленные вопросы, развивая при этом свою речь, логику мышления и умение отстаивать свою точку зрения.
Демонстрационный эксперимент по изучению свойств разбавленной и концентрированной серных кислот позволяет учащимся самостоятельно ответить на ряд поставленных вопросов, провести сопоставление, проверить достоверность сделанных предположений, развить практические умения и навыки в работе с кислотами.