Тема: Щелочные металлы.
Девиз: «Чтоб познать, нужно научиться наблюдать!»
Наблюдательность – это сосредоточенность,
внимательное отношение к деталям,
изобретательность и настойчивость!
Г. Сиборг
Цели:
1. Систематизировать знания о строение атомов щелочных металлов.
2. Изучить свойства и особенности, применение и нахождение в природе щелочных металлов.
3. Продолжить работу по развитию умений составлять уравнения химических реакций.
Тип урока: обретение новых знаний.
Оборудование и реактивы: мультимедийное оборудование, фарфоровый стакан, спиртовка, лучинка, проволока, спиртовка, хлорид натрия, хлорид калия, фенолфталеина, вода, металлический натрий.
Изучение новой темы
План урока:
1. Нахождение в природе и положение в периодической системе элементов Д. И. Менделеева.
2. Физические свойства.
3. Химические свойства.
4. Применение соединений щелочных металлов.
5. Закрепление изученной темы.
6. Домашнее задание.
7. Подведение итогов урока и выставление оценок
Ход урока
Занятие сопровождается компьютерной презентацией. (Приложение 1)
1. Нахождение щелочных металлов в природе и в периодической системе элементов Д.И. Менделеева
Начинаем изучение отдельных элементов с наиболее ярко выраженными металлическими свойствами – со щелочных металлов. Почему эти металлы называют щелочными? (Так как они, растворяясь в воде, образуют щелочи.)
Охарактеризуйте строение атомов щелочных металлов, используя периодическую систему. На доске двое учащихся рассказывают и распределяют электроны атомов щелочных металлов по электронным слоям:
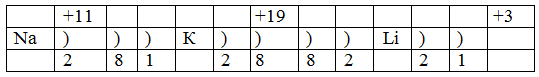
Обучающиеся подводят итог:
1. Щелочные металлы образуют I группу главную подгруппу.
2. Имеют по одному электрону на внешнем слое.
3. Всегда положительно заряженные.
4. Всегда одновалентные и образуют ионные связи.
Натрий присутствует в атмосфере Солнца, в космическом пространстве. Есть натриевый пояс Земли, на высоте 80 км обнаружен слой атомарного натрия, так как там практически нет кислорода и воды.
Натрий и другие щелочные металлы в природе в свободном виде не встречаются. Впервые натрий и калий были получены в 1807 г электролизом. Электролиз осуществил Дэви.
Месторождение соединений натрия и калия в природе:
1. Сильвинит КСl*NaCl – в Соликамске.
2. Карналлит КСl*MgCl2*6H2O – в Солигорске.
3. Каменная соль NaCl, глауберова соль Na2O4* H2O – в заливе Кара – Богаз – Гол на Каспийском море, в соляных озерах Эльтон и Баскунчак, г. Соликамске.
4. Натриевая селитра NaNO3 (чилийская селитра) – в Чилии.
Натрий по распространенности занимает шестое место среди всех элементов на нашей планете. Не удивительно, что с соединениями натрия предки наши познакомились очень давно. Питекантропу хлорид натрия был также нужен, как и современному человеку.
2. Физические свойства
Демонстрация слайда 1 «Важнейшие физические свойства щелочных металлов».
Изучив слайд, приходим к следующему выводу. С возрастанием порядкового номера щелочных металлов увеличиваются радиусы их атомов. Внешний, или валентный электрон все дальше отодвигается от ядра, притяжение к которому экранируется внутренними электронами, и связь его с ядром все более ослабляется, особенно у цезия. Электроны из атомов цезия легко выбрасываются при освещении поверхности металла.
3. Химические свойства
1. В фарфоровую чашку с водой бросим кусочек небольшой натрия.
Что наблюдаете? (Выделение газа.)
Какой газ выделяется? (Выделяется водород.)
Докажите, что выделился водород? (Преподносим горячую лучинку. Слышим хлопки.)
Какое еще вещество образуется в стакане? (Гидроксид натрия.)
Обоснуйте свой ответ. (Добавим фенолфталеин, наблюдаем окрашивание в малиновый цвет.)
Пишем уравнение реакции: 2H2O + 2Na = 2NaOH + H2.
2. Как вы думаете, почему натрий и другие щелочные металлы хранят под слоем керосина? (Окисляются.)
2Na + O2 = Na2O2.
2Na2O2 = 2 Na2О + O2.
Это свойство пероксида натрия используется для получения чистого кислорода в подводных лодках.
3. Взаимодействие с водородом.
2Na + Н2 =2NaН – гидрид натрия.
4. Взаимодействие с галогенами. В прибор для демонстрации горения металлического натрия в хлоре помещаем в первый отдел диоксид марганца 2г и пипеткой наливаем 1мл концентрированной серной кислоты, а во второй отдел кладем металлический натрий и пробирку закрываем ватным тампоном, смоченным раствором едкого натра. Натрий нагрели до образования хлора. В токе хлора горит натрий.
2Na + Сl2 = 2NaCl – хлорид натрия.
5. Взаимодействие металлов с раствором кислот:
2HСl + 2Na = 2NaСl + H2.
Характерным свойством щелочных металлов является окрашивание пламени.
Демонстрируется опыт.
Прокаливается железная проволока до тех пор, пока не перестанет ею окрашиваться пламя, затем вносится в пламя на кончике проволоки раствор соли натрия. Наблюдаем окрашивание пламени ионами натрия в желтый цвет. Затем протирается проволока о руку и вновь вносится в пламя. Снова наблюдаем окрашивание пламени спиртовки в желтый цвет.
О чем это говорит? (При трении о кожу проволоки она загрязнилась ничтожным количеством соединения натрия, так как пот содержит соль – хлорид натрия.)
Желтое свечение паров натрия использовался 3 января 1959 г в полете одной из советских космических ракет для определения ее местонахождения в момент выбрасывания из нее паров натрия по сигналу с Земли.
Опыт повторяется, используя хлорид калия. Наблюдаем окрашивание пламени в фиолетовый цвет.
4. Применение соединений щелочных металлов
Из химических элементов периодической системы Д.И. Менделеева природа в качестве основы жизни выбрала шесть основных элементов: С, Н, О, N, S, Р.
Установлено, что есть десять металлов, совершенно необходимых для любого организма, их называют «металлы жизни». В организме человека весом 70 кг содержится: Са – 1700 г, К – 250 г, Na – 70 г, Мg – 4 г, Zn – 3 г, Сu – 0,2 г; Мn, Со, Мо, по 0,1 г.
Натрий и калий – компоненты почвы и почвенных растворов. Калий – элемент питания растений. При усилении калийного питания повышается морозостойкость растений, интенсивность углеродного питания, в результате в листьях образуется больше крахмала.
При недостатке калия по краям листьев появляются бурые пятна, только центральная часть листка около жилок остается зеленой, уменьшается стойкость растений против грибковых заболеваний.
Избыток натрия в почве вызывает засоление почвы, что связано с избыточным содержанием солей Na2SO4 и Na2СO3. На засоленных почвах плохо растут растения, теряют упругость листья, появляются трещины на поверхности почвы.
Замена калия и натрия на литий в организме животных вызывает расстройство нервной системы.
Хлорид натрия применяется в ветеринарии, в медицине – физиологический раствор 0,85% NaCl. Также его используют для консервирования и приготовления пищи (в год человек использует около 7–8 кг соли), для выделки кожи, при крашении.
В прошлом из-за соли возникали и народные волнения («соляные бунты»), в некоторых странах куски соли служили разменной монетой.
NaCl добывается из соляных озер и залежей каменной соли. Когда-то это были морские заливы. Отделившись от моря, заливы превратились в озера. Озера пересыхали, и на дне их осаждался NaCl. На месте древних, окончательно высохших озер образовались залежи каменной соли.
Поваренная соль, сода, мыло, стекло – вот важнейшие из химических соединений натрия, используемые нами в повседневной жизни. Натрий, который содержится в оконном стекле, в куске мыла, как и натрий, входящий в состав нашей крови, когда-то содержался в океане. Из океана образовался соляной пласт (всем вам известны горы Шиханы, слайд 3); из пласта была добыта поваренная соль, далее она попала в пищу или на химический завод (например, ОАО «Сода» в г. Стерлитамаке), где она была превращена в соду, а сода в стиральный порошок, мыло, стекло и другие продукты широкого потребления. Сода стала одним из важнейших продуктов химической промышленности. Так завод ОАО «Сода», который находится в небольшом городке, один из крупнейших в Европе по производству соды.
Затем выступают: юный географ, юный историк, юный химик, юный биолог. (Приложение 2)
19 ноября 1807 г английский химик Хэмфри Дэви объявил об открытии Na и К.
Широкое применение нашли и другие щелочные металлы. Добавка лития к разным металлам позволяет получить легкие и прочные металлы.
Смазка, изготовленная с применением LiOH, не замерзает при t = -50 С. На этой смазке безотказно работают тягачи в поселке «Мирный» в Антарктиде.
Сs применяют в фотоэлементах, телевидении, кинематографе, автоматике.
Rb применяют в полупроводниках, электронно-вычислительных машинах.
5. Закрепление изученной темы
а) Решение задачи.
При растворении в воде 1,75 г щелочного металла выделилось 2,8 л водорода (н. у.). Определите металл.
б) Химический диктант.
Напишите названия следующих химических формул:
Na2O –
Na2O2 –
NaH –
NaNO3 –
NaCl –
в) Решить чайнворд, задания в приложении.
г) Программированный опрос (задания в Приложении 2).
д) «Побегушки».
Вычислить какой объем газа выделится если на 100 г соляной кислоты опустить кусочек натрия (н. у.).
6. Домашнее задание
7. Подведение итогов урока и выставление оценок