Цели урока: формирование представлений о науке экологии и химии; их взаимосвязи, воздействие загрязнителей на окружающую среду (ОС) и человека. Показать воздействие загрязнения экосистемы в целом, отдельных ее слагаемых – живых организмов и условия их обитания. Выработать умение анализировать изучаемые явления; формирование бережного отношения к своему здоровью и здоровью окружающих.
Оборудование и реактивы: подъемный столик, сетка, песок, бихромат аммония, лучинка; на столах учеников: лакмус, прибор для получения газов, мел, соляная кислота, вода, нитрат бария, сульфат натрия, сульфат меди(ІІ), гидроксид натрия, хлорид натрия, нитрат серебра(І)
Ход урока
1. Организационный момент
2. Основная часть
Учитель биологии: Человек начал наблюдать за природой около 2 млн. лет назад. В результате наблюдений возникли следующие вопросы: Гармонично ли устроена природа? Уравновешены ли в ней процессы созидания и разрушения? Неизменны ли круговороты химических элементов? Насколько все взаимосвязано в живой природе? На эти и множество других вопросов предстоит ответить экологии (от греческого «ойкос» - «место обитания» и «логос» - «учение») – науке, изучающей живой облик планеты.
В 1866 году слово «экология» предложил немецкий зоолог и философ Эрнест Геккель. Современная экология теснейшим образом связана с философией, генетикой, химией и географией.
На уроке мы должны увидеть логическую взаимосвязь между экологическими и химико-экологическими понятиями.
Учитель химии: Химическая экология – наука о химических взаимодействиях организмов между собой и с ОС. Приведите примеры естественных химических взаимодействий организмов между собой и ОС.
Ученик: Без азота невозможна жизнь. Он является основным компонентом белка. Природа позаботилась о том, чтобы использовать такой колоссальный источник вещества, как атмосферный воздух. Если на истощенном от долгого использования участке земли посеять бобовое растение (клевер, горох или люцерну), то плодородие почвы восстанавливается. Об этом свойстве знали античные земледельцы. Но лишь в 1866 году ботаник и почвовед М.С.Воронин увидел во вздутиях на корнях бобовых мельчайшие тельца – особые бактерии. Через 20 лет Мартин Виллем Бейеринк подтвердил эту догадку: но выделил из клубеньков гороха бактерии, которые были названы клубеньковыми, или ризобиями. Попав из почвы на молодые корешки бобовых, ризобии проникают в них и образуют клубеньки, в которых живут. Они усваивают азот из воздуха и снабжают им почву. Это явление называется азотфиксацией, а содружество бактерий и растений – симбиозом.
Учитель химии: Каким бывает загрязнение ОС по своей природе?
Ученик: Загрязнения могут быть (на интерактивной доске):
- Физические – загрязнения, которые влияют на физические характеристики ОС: температуру, освещенность, уровень шума и другие.
- Химические - загрязнения, которые изменяют химический состав атмосферы, гидросферы и литосферы.
- Биологические – загрязнения, которые характеризуются привнесением живых организмов нежелательных или нехарактерных для данной экосистемы.
Учитель биологии: Выполните задание №1 (на интерактивной доске).
Задание №1
Распределите загрязнения ОС по типам в зависимости от их природы:
Ионы тяжелых металлов в питьевой воде;
Сильный шум;
Колорадский жук на огороде;
Вибрация;
Повышение температуры воды в озере из-за сброса в него теплой воды от ТЭЦ;
Нефтяная пленка на поверхности моря;
Васильки и мак на хлебном поле;
Избыток углекислого газа в атмосфере;
Пестициды, используемые в сельском хозяйстве.
Учитель биологии: В зависимости от источников загрязнение ОС может быть естественным или антропогенным. Что такое естественное загрязнение ОС? Что такое антропогенное загрязнение ОС?
Ученик: Естественное загрязнение – это загрязнение, которое вызывается процессами, происходящими в природе без вмешательства человека. Антропогенное загрязнение – это загрязнение, вызванное деятельностью человека.
Учитель биологии: Выполните задание № 2 (на интерактивной доске).
Задание №2
Разделите приведенные примеры на естественные и антропогенные источники загрязнения ОС:
Угарный газ, выделяющийся двигателем внутреннего сгорания на холостом ходу;
Удобрения, смываемые с поля в водоем;
Сероводород, как продукт жизнедеятельности анаэробных бактерий;
Зола, остающаяся после сжигания угля;
Метан, выходящий из трещин в земной коре;
Хлоркальциевые стоки содового производства;
Остатки СМС, попадающие в городскую канализацию;
Сернистый газ, выделяющийся при извержении вулкана.
Учитель биологии: Какие результаты воздействия загрязнителей ОС на атмосферу вы знаете?
Ученики: (подчеркнутые термины на интерактивной доске)
- Парниковый эффект – повышение средней температуры атмосферы из-за увеличения содержания в ней СО2 и некоторых других газов, препятствующих тепловому излучению с поверхности Земли выйти за пределы приземной атмосферы.
- Озоновые дыры – существенное (около 50 %) снижение плотности озонового экрана. Впервые оно было отмечено над Антарктидой.
- Озоновый экран – слой озона в верхних слоях атмосферы (на высоте 25-30 км над уровнем моря), защищающий Землю от губительного для живых организмов УФ-излучения Солнца. От избытка УФ-излучения могут пострадать даже самые низшие формы жизни: УФ-излучение разлагает хроматин клеточного ядра, прекращает деление и размножение клеток, у человека вызывает повреждения ДНК, нарушение генетического кода, менее жёсткое излучение – нарушение зрения, ожоги кожных покровов.
- Аэрозольный эффект – результат снижения прозрачности атмосферы за счёт присутствия в ней аэрозолей. Аэрозоль – взвешенные в газообразной среде частицы твёрдых или жидких веществ. Аэрозоль с жидкими частицами – туман, с твёрдыми – дым. Радиус твёрдых частиц 10-8 – 10-2см., капель – 10-5 – 10-1 см. снижение прозрачности атмосферы уменьшает солнечную радиацию, достигающую поверхности Земли, т.к. земное излучение существенно не изменится при этом, то результатом будет снижение температуры поверхности Земли. В этом смысле аэрозольный эффект противостоит парниковому.
Учитель химии: сейчас вы увидите опыт «извержение вулкана», который наглядно покажет загрязнение ОС из-за учащений и усилений стихийных бедствий.
(Демонстрация опыта «извержение вулкана»)
Ученик записывает уравнение химической реакции, расставляет коэффициенты методом электронного баланса и указывает процессы окисления и восстановления, окислитель и восстановитель.

Учитель биологии: Какие ещё виды загрязнений ОС вы знаете?
Ученики:
- Смог – токсичный туман, опасное загрязнение атмосферного воздуха, характеризующееся сочетанием пылевых частиц и капель. Образуется главным образом при инверсиях температур.
- Смог лондонского типа – сочетание газообразных загрязнителей (в основном сернистого ангидрида), пылевых частиц и тумана. Это загрязнение достигло особенно опасных масштабов в 50-е годы над Лондоном. Главный источник – сжигание серосодержащих сортов угля и мазута.
- Смог Лос-Анжелесского типа – смог, из компонентов которого под дейстьвием УФ-излучения образуются новые, иногда более опасные загрязнители. Впервые был обнаружен в 30-е годы над Лос-Анжелесе. Основной источник – автотранспорт.
- Кислотные осадки – осадки рН которых <5,6 из-за растворения в атмосферной влаге промышленных выбросов (SO2, NO2, СО2 и др.).
Учитель химии: Инструктаж по технике безопасности. Докажем образование угольной кислоты (Н2СО3) при взаимодействии углекислого газа (СО2) с водой (Н2О). Как доказать наличие образовавшейся кислоты?
Ученик: При помощи качественной реакции – добавления лакмуса. Наблюдаем изменение окраски в розовый цвет. Записывает уравнения реакций(получение углекислого газа и взаимодействие его с водой).
СаСО3+2НСI = СаСI2 + СО2↑ + Н2О
СО2 + Н2О = Н2СО3 (лакмус краснеет)
Учитель биологии: Какие воздействия загрязнителей ОС на почвы вам известны?
Ученик:
- Засоление почв – увеличение содержания легкорастворимых солей в почве (свыше 0,25%), приводящее к образованию солонцеватых и солончаковых почв. Может быть обусловлено засолённостью почвообразующих пород (остаточное засоление), неправильным орошением (одна из главных причин), привнесением солей грунтовыми и поверхностными водами и др.
Учитель химии: Инструктаж по технике безопасности. Проводим и объясняем опыт «Способы борьбы с засолением». Чтобы удалить ионы Cl-, SO42-, Cu2+ необходимы дорогостоящие химические реагенты, что экономически не выгодно.
SO42- + Ba2+ → BaSO4↓
Cl- + Ag+ → AgCl↓
Cu2+ + 2OH- → Cu(OH)2↓
Ученик:
- Закисление, выщелачивание почв – см. «Воздействие загрязнителей ОС на физико-химических факторов среды».
Учитель химии: демонстрация опыта химических способов борьбы с закислением и выщелачиванием:
2H+ + CO32- → H2O + CO2↑- ученик записывает уравнение. В домашних условиях применяют измельченную яичную скорлупу.
Учитель биологии: Какие воздействия загрязнителей ОС на техногенные системы вам известны?
Ученик:
- Коррозия – процесс окисления металла под действием химических агентов или физико-химических факторов среды.
Учитель химии: от коррозии ежегодно гибнет значительная часть производимого железа, а в некоторых странах до 25%. В среднем, каждая шестая доменная печь работает на восстановление корродированного металла (демонстрация опыта по коррозии металла, заложенного заранее учеником).
Ученик: Коррозии подвергаются различные металлы и сплавы, но наиболее часто приходится сталкиваться с коррозией самого распространенного металла – железа и его различных сплавов. Поэтому рассмотрим коррозию железа подробнее.
Выясним, какие условия способствуют, а какие препятствуют коррозии железа. С этой целью заранее подготовлен в лаборатории следующий опыт.
Поместим железный гвоздь в пробирку, наполним ее доверху водой и опрокинем, зажав отверстие пальцем, в сосуд с водой. После чего вытесним воду из пробирки кислородом. Таким образом заготовим другие пробирки с гвоздями, но вместо чистой воды в пробирки и сосуды, в которые они будут опрокинуты, нальем раствор хлорида натрия. В одном случае к этому раствору добавим немного раствора гидроксида натрия. К одному из гвоздей заранее прикрутим медную проволоку, к другому – полоску цинка. Спустя примерно сутки мы увидим картину, представленную на рисунке 1. О том, как протекала коррозия в каждом случае, вы можете судить по объему израсходованного кислорода, т.е. по поднятию уровня жидкости в пробирке и по характеру осадившегося в воде продукта коррозии.
Сравним результаты опытов 2 и 3. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с медью, а в другом – нет. И там и здесь произошла коррозия и появился бурый осадок ржавчины. Но в опыте 2 ржавчины получилось мало, а в опыте 3 – много. Соответственно этому и расход кислорода в опыте 2 был мал (уровень раствора в пробирке поднялся невысоко), в опыте 3 – велик. Таким образом, коррозия, или ржавление, железа резко усиливается, когда оно соприкасается с медью. Сравним теперь результаты опытов 2 и 4. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с цинком, а другом – нет. Наблюдается сильная коррозия: много израсходовалось кислорода и получился обильный осадок. Но в опыте 2 осадок бурого цвета – это ржавчина, а в опыте 4 осадок белого цвета – это гидроксид цинка. Следовательно, в опыте 4 корродировало не железо, а цинк. Таким образом, железо практически не корродирует, если оно соприкасается с цинком.Усиление коррозии железа в первом случае и прекращение во втором объясняется возникновением гальванических элементов. Так, при соприкосновении железа с цинком возникает гальванический элемент, в котором будет окисляться цинк как более активный металл. При окислении цинка образуются ионы Zn2+, а отщепляющиеся от его атомов электроны перемещаются на поверхность железа и восстановливают ионы водорода, содержащиеся в растворе.
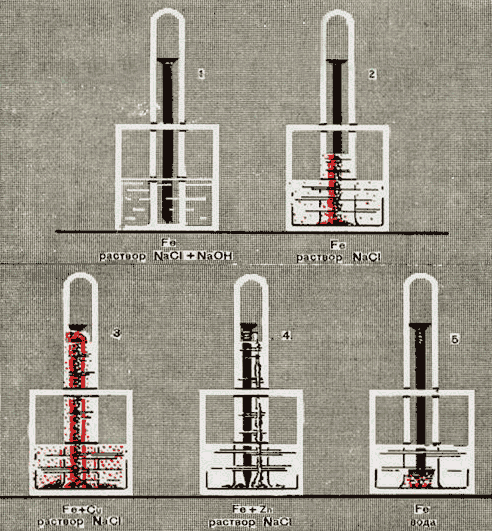
Рис. 1 Коррозия железного гвоздя в разных условиях
При соприкосновении железа с медью тоже возникает гальванический элемент, но в нем будет окисляться более активный металл- железо. Окислителем при коррозии в водной среде обычно выступает кислород. Реакция растворенного в воде кислорода с железом приводит к образованию бурой ржавчины. Состав ржавчины переменный; приблизительно он может быть выражен формулой Fe(OH)3 • xH2O. Схему этого процесса условно запишем так:
4Fe + 3O2 + 6H2O → 4Fe(OH)3
Fe(OH)3 + xH2O → Fe(OH)3 • xH2O
Как следует из результатов опыта, коррозия металла резко усиливается, если он соприкасается с каким-либо другим, менее активным металлом, т.е. расположенным в электрохимическом ряду напряжений металлов, т.е. более активным.
Сравним результаты опытов 1 и 2. Добавка к воде хлорида натрия усилила коррозию железа: получилось много ржавчины и много израсходовалось кислорода. Добавка к раствору хлорида натрия гидроксида натрия, как видно из опыта 5, наоборот, ослабила коррозию, ржавчины получилось мало и кислорода израсходовалось немного.
Таким образом, скорость коррозии данного металла зависит от состава омывающей металл среды. Одни составные части омывающей металл среды, в частности хлорид-ионы, усиливают коррозию металлов, другие составные части могут ослаблять коррозию. Так, коррозия железа ослабляется в присутствии гидроксид-ионов.
Теперь мы можем понять широко используемые на практике способы предупреждения и борьбы с коррозией.
Учитель биологии: ребята, на протяжении сегодняшнего урока мы рассмотрели разные виды загрязнений окружающей среды. А какие же последствия для окружающей среды и человека могут они вызывать?
Ученик:
- Из-за сдвига климатических зон в сторону полюсов, произойдет расшатывание экосистем, т.к. растениям и животным придется кочевать вслед за уходящими климатическими зонами или приспосабливаться к новым условиям – в результате сложившиеся экосистемы будут заменяться на новые, менее устойчивые;
- Опустынивание одних земель и заболачивание других из-за изменения режима выпадения осадков. Вымирание водных организмов из-за повышения кислотности водоемов.
- Гибель растений вследствие закисления почв или из-за выщелачивания;
- Уменьшение площади суши, т.е. сокращение жизненного пространства и пахотных земель вследствие подъема уровня моря;
- Учащение и усиление стихийных бедствий: наводнений, засух, штормовых ветров, тропических циклонов;
- Эпидемии из-за изменения влажности и температуры, что приведет к изменению путей распространения болезней, зависящих от переносчиков и вирусов;
- Нарушение структуры хромосом и подавление синтеза галактолипидов и хлорофилла. Как следствие, нарушение суммарной проницаемости клеточной оболочки, т.е. фотосинтеза, дыхания и осморегуляции.
3. Подведениет итогов урока. Выставление отметок
Домашнее задание: записи урока, подобрать свои примеры загрязнений ОС.