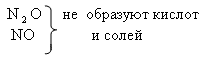Тема урока: Соли азотной и азотистой кислот.
Тип урока: Изучение нового материала.
Цели урока:
- Образовательная: сформировать знания об особенных свойствах азотной и азотистой кислот, способах получения их солей и областях применения.
- Развивающая: продолжить развивать навыки и умения: выделять главное, устанавливать причинно – следственные связи, проводить эксперимент и применять полученные знания на практике.
- Воспитательная: развивать коммуникативные навыки общения: уметь слушать слышать.
Методы и методические приёмы: самостоятельная работа детей с дополнительной литературой для подготовки сообщений, выполнение лабораторных опытов, текущий контроль знаний с помощью теста.
Оборудование и реактивы:
- Плакат по технике безопасности.
- Таблицы: «Разложение нитратов при нагревании».
- Классификация азотных удобрений.
- Тест.
- Для демонстрации опыта:
- медная проволока,
- азотная кислота (конц.),
- нитрат серебра,
- цинк,
- нитрат меди-2,
- гидроксид натрия,
- хлорид бария,
- оксид кальция.
Структура урока:
- Организационный момент.
- Объявление темы и целей урока.
- Проверка домашнего задания
- Изложение нового материала – беседа с опорой на эксперимент.
- Текущий контроль знаний.
- Сообщение домашнего задания.
- Рефлексия.
ХОД УРОКА
Учебно-воспитательный момент (этапы) урока |
Цель |
Методы работы и формы организации познавательной деятельности учащихся. |
| I. Объявление темы и целей урока Инструктаж
по технике безопасности. II. Проверка домашнего задания У доски работают два учащихся: 1. Получение аммиака, его химические свойства. Класс в это время разбирает домашнее задание упр.4.Стр.155. III. Изложение нового материала Учитель: Азот образует пять оксидов:
N2O3 – образует азотистую кислоту H NO2и
её соли – нитриты. Учитель демонстрирует взаимодействие азотной кислоты с медью и запись уравнения реакции: Учитель: Ни один из металлов не
вытесняет из азотной кислоты водород,
независимо от концентрации. Это и объясняет
тем, что азотная кислота сильный
окислитель, и азот имеет максимальную степень
окисления +5. Учитель: Какой продукт мы получили в ходе демонстрационного эксперимента. Учитель: Какая связь существует между строением вещества и его свойством, мы узнаем из лабораторного опыта. (Соли нитраты) Физические свойства нитратов В две пробирки положили кристаллические нитраты:нитрат бария и нитрат алюминия. В пробирки прилили два миллилитра дистиллированной воды, помешали стеклянной палочкой. Учащиеся обнаружили, что соли растворяются. Учитель: Что называют солями? Химические свойства нитратов Учащиеся выполняют лабораторную работу. 1. Взаимодействие с металлами, кислотами, солями, щелочами.
2. Гидролиз нитратов: Определить реакцию среды растворов: Al(No3)3 и
Ba(No3)2 Специфические свойства нитратов и нитритов Учитель: Все нитраты при нагревании
разлагаются при образовании кислорода. Характер
других продуктов реакции зависит от положения
металла. которые образует нитрат, в
электрохимическом ряду напряжений. Учитель
обращает внимание учащихся на
электрохимический ряд напряжения металла.
Учитель демонстрирует опыт. Учитель: Какие выделились газы? Что
осталось в пробирке? Учащиеся записывают уравнения в тетрадях, один ученик у доски Учитель: Что является качественной реакцией на нитрат – ион HNO3–? Оказывается, чтобы распознать ион HNO3– необходимо осуществить следующее, взаимодействие нитратов с металлической медью в присутствии концентрированной серной кислоты. Демонстрация опыта: Качественная реакция на ион HNO3–. В большую сухую пробирку поместить медную пластинку предварительно её, зачистив, несколько кристалликов KNo3, прилить концентрированную серную кислоту. Пробирку закрыть ватным тампоном, смоченным раствором щёлочи и нагреть. Учитель просит назвать признаки реакции. Ученик: В пробирке бурый пар это – NO3, появляются зеленоватые кристаллики нитрата меди – II. Ученик записывает уравнения у доски KNo3 + H2SO4 = KHSO4 + HNO3 Cu0 + 4HN+5O3 = Cu ( No3)2 + 2N+4O2 + 2H2O Затем учитель демонстрирует схему уменьшения силы кислот
H2SO4 HCl H2SO3 H2CO3 H2S H2SiO3 ––>
В соответствии с рядом кислот каждая предыдущая кислота может вытеснить из соли последующую. Затем выступают учащиеся с сообщениями. 1. Влияние нитратов на окружающую среду на организм человека. Азот основной питательный элемент, который
влияет на рост вегетативных органов –
стеблей и листьев. Азотные удобрения
рекомендуются вносить поздней осенью или ранней
весной, так как талые воды смывают половину
удобрений. Важно соблюдать нормы и сроки
внесения, вносить в несколько приёмов.
Избыточное употребление азотных удобрений не
только ведёт к аккумуляции нитратов в
растениях, но и приводит к загрязнению
окружающей среды. Один из признаков
загрязнения водоёма, цветение воды, вызванная
буйным размножением водорослей. 2. Где применяются нитраты и нитриты. Нитрат серебра, который чернит ткать, бумагу (ляпис) применяют как противомикробное средство для лечения кожных язв, прижигания бородавок, основный нитрит висмута назначают внутрь при язвенной болезни желудка и двенадцатиперстной кишки. Наружно – в мазях, присыпках при воспалительных заболеваниях кожи. Нитрит натрия применяют в медицине как спазмолитическое средство. Нитриты применяют в колбасном производстве 7 г на 100 кг. фарша. Нитриты придают колбасе розовый цвет. К тому же присутствие нитритов необходимо ещё и по другой причине: они предотвращают развитие микроорганизмов, выделяющих токсические вещества. IV. Текущий контроль знаний 1. Наиболее прочная молекула:
2. Степень окисления +3 у азота:
3. Сильные электролиты:
4. Водород выделяется при взаимодействии:
5. Укажите число ионов в сокращённом ионном уравнении взаимодействии сульфата натрия и нитрата серебра:
Ответы: 1 – г, 2 – г, 3 – а, 4 – в, г, 5 – в. V. Сообщение домашнего задания: Учебник: Габриеляна – Химия – 9 класс. VI. Рефлексия – Что нового вы узнали на уроке? |
Подготовить учащихся к активной деятельности на уроке. Проверка усвоения темы «Соли аммония» Сформировать знания об особенных свойствах азотной кислоты Продолжить развивать навыки и умения: выделять главное, устанавливать причинно-следственные связи. Продолжить развивать навыки и умения проводить эксперименты и применять полученные знания в практике. Выяснить качественную реакцию на ион Выяснить: как влияют нитраты и нитриты на окружающую среду и организм человека. и их применение. Текущий контроль знаний. |
Слово учителя. Индивидуальная и фронтальная работы Фронтальная работа. Фронтальная работа. Индивидуальная работа. Работа в парах Фронтальная работа и индивидуальная Фронтальная и индивидуальная работа Индивидуальная работа Фронтальная работа |